Dr.ssa Francesca Romana Prandi1, Dr.ssa Federica Illuminato1, Dott.ssa Chiara Galluccio1, Dott.ssa Marialucia Milite1, Dott. Massimiliano Macrini1, Dott. Alessio Di Landro1, Dott. Gaetano Idone1, Dott. Marcello Chiocchi2, Prof. Francesco Barillà1
1 Dipartimento di Cardiologia, Università degli Studi di Roma Tor Vergata
2Dipartimento di Radiologia, Università degli Studi di Roma Tor Vergata
ABSTRACT
Paziente di 33 anni, fumatore, dislipidemico non in trattamento, veniva ricoverato al Pronto Soccorso per dolore toracico. Posta diagnosi di STEMI anteriore, veniva sottoposto a coronarografia e PTCA primaria mediante impianto di DES su discendente anteriore (DA) prossimale; la coronarografia inoltre, metteva in evidenza un’origine anomala dell’arteria circonflessa dalla coronaria destra. L’ecocardiogramma color Doppler evidenziava ipertrabecolatura lungo la parete libera del ventricolo sinistro, fortemente suggestiva per miocardio non compatto, diagnosi confermata successivamente dalla risonanza magnetica cardiaca.
INTRODUZIONE
Il miocardio non compatto (MNC) è una rara patologia congenita del muscolo cardiaco caratterizzata da una marcata ipertrabecolatura parietale, dovuta all’arresto del processo di maturazione miocardica ed endocardica durante lo sviluppo fetale, che porta alla persistenza di strutture embrionali nel muscolo cardiaco1. Il MNC può essere una patologia isolata, ma talora può associarsi ad altre malformazioni congenite, come ad esempio disordini neuromuscolari, altre anomalie cardiache ed origine anomala delle coronarie2. Il dolore toracico non è inusuale in questi pazienti: esso può essere presente in circa il 40% dei casi e solitamente in assenza di lesioni coronariche significative3. In uno studio coronarografico su 74 pazienti con MNC, Stollberger e Finsterer hanno riscontrato un’anomalia delle coronarie in sette pazienti e lesioni coronariche significative in due pazienti2. Alcuni autori hanno evidenziato che nei pazienti con MNC è spesso presente una ridotta riserva di flusso coronarico, suggerendo che la disfunzione del microcircolo possa essere responsabile delle alterazioni della cinesi4. Pertanto, nel paziente con MNC l’angina può avere una origine duplice: o secondaria ad una ridotta riserva coronarica per una malattia aterosclerotica, oppure secondaria ad un’alterazione del microcircolo5.
Frequentemente la diagnosi viene effettuata precocemente, ma può avvenire anche più tardivamente, in età adulta, e spesso è sottostimata. La diagnosi di MNC può essere effettuata mediante ecocardiogramma color-doppler e confermata mediante RMN cardiaca. I criteri morfologici ecocardiografici attualmente più diffusamente utilizzati sono i criteri di Jenni, che prevedono la coesistenza di due strati miocardici separati, uno compatto (C) epicardico ed uno non compatto (NC) endocardico, con un rapporto NC/C >2 in telesistole (sezione parasternale asse corto), associato alla presenza di segnale color Doppler all’interno dei recessi intertrabecolari6. I segmenti più frequentemente coinvolti sono localizzati a livello dell’apice e dei segmenti medi della parete laterale e inferiore, spesso ipocinetici per ipoperfusione subendocardica, ridotta riserva di flusso coronarico e disfunzione del microcircolo7.
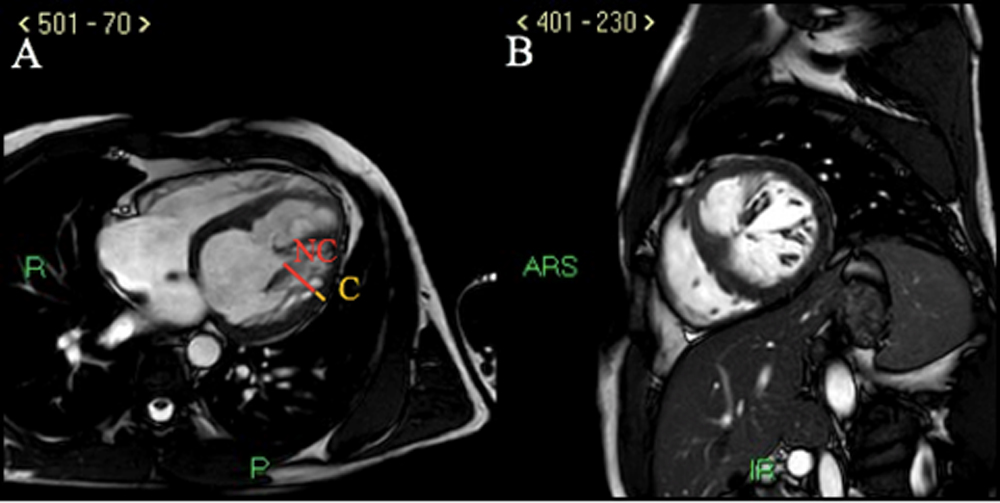
Petersen et al. definiscono come criteri per la diagnosi di MNC su immagini cine-RM la presenza di un rapporto tra miocardio NC/C >2.3, su sezioni lungo-assiali in telediastole; la diagnosi può essere poi avvalorata da criteri clinici quali la familiarità di primo grado per la patologia, l’associazione con patologia neuromuscolare, la storia di eventi tromboembolici, la presenza di anomalie della cinetica regionale e di aritmie maligne8.
CASO CLINICO
Presentiamo il caso clinico di un paziente di 33 anni, di nazionalità rumena, fumatore, dislipidemico non in terapia farmacologica, in assenza di familiarità per malattie cardiovascolari e precedenti cardiologici di rilievo. Il paziente si recava presso il Pronto Soccorso in seguito ad esacerbazione di episodi di dolore toracico in sede precordiale irradiato al braccio sinistro, insorti da qualche giorno, di breve durata, non correlati allo sforzo fisico. L’esame obiettivo generale e l’obiettività cardiopolmonare risultavano nei limiti di norma, in assenza di dismorfismi facciali. Gli esami ematochimici documentavano incremento dei markers di miocardiocitonecrosi (Troponina I hs 49308.7 ng/L, Mioglobina 2494 ng/ml, CK-MB 252 ng/ml), e degli indici di funzionalità epatica (GOT 263 U/L, GPT 116 U/L), con normale funzionalità renale, emocromo ed emoglobina glicosilata.
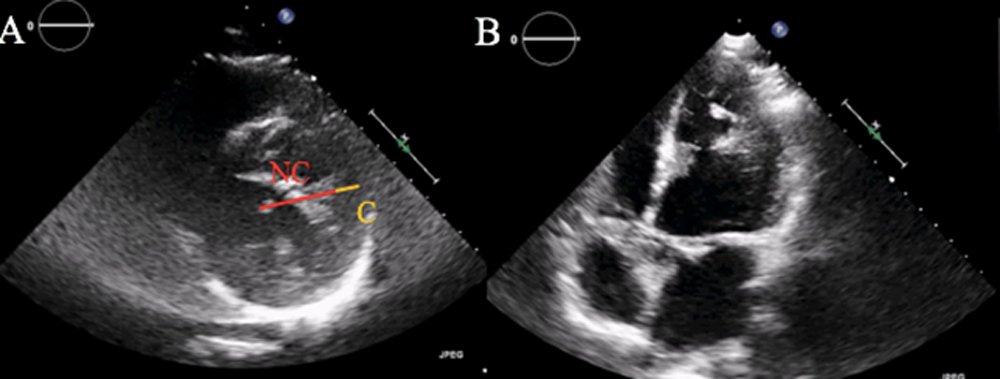
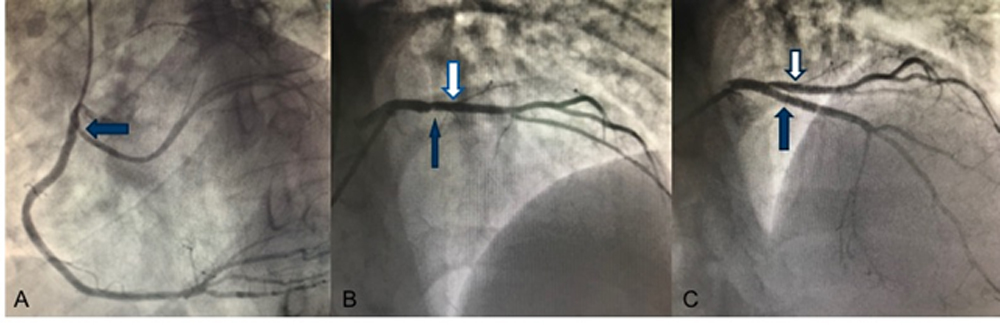
L’ECG mostrava RS alla FC di 65 bpm, con sopraslivellamento del tratto ST-T in sede anteriore ed anomalie diffuse della ripolarizzazione ventricolare. Posta diagnosi di STEMI anteriore, il paziente veniva inviato presso la sala di Emodinamica e sottoposto a coronarografia con riscontro di origine anomala della coronaria circonflessa dalla coronaria destra (Fig. 1, A) e stenosi critica sull’arteria discendente anteriore prossimale (Fig.1, B) trattata con PCI primaria ed impianto di un DES con buon risultato angiografico finale (Fig.1, C). Al termine della procedura il paziente veniva trasferito presso l’Unità di Terapia Intensiva Coronarica. Agli esami ematochimici, il profilo lipidico risultava oltre i limiti normali di riferimento (Colesterolo LDL 137 mg/dl). L’Ecocardiogramma color-doppler documentava ventricolo sinistro (VS) di dimensioni endocavitarie aumentate con aumentati spessori parietali, acinesia dell’apice in toto, del SIV e della parete anteriore, FE 30%, e si segnalava ipertrabecolatura della parete laterale del VS in presenza di multiple prominenti trabecolature, con profondi recessi intertrabecolari, comunicanti con le cavità, suggestiva per non compattazione ventricolare (Fig.2, A e B), non alterazioni morfo-flussimetriche di rilievo a carico degli apparati valvolari. Il paziente veniva pertanto sottoposto a RMN cardiaca (Fig.3, A e B) che documentava VS dilatato, FE: 34 %, assottigliamento della parete antero-settale ed anteriore di tutto il VS ed in sede apicale, acinesia della parete anteriore ed antero settale del VS (dove si riscontrava anche aumento dei valori di T1 mapping e aree di LGE dopo iniezione di mezzo di contrasto, compatibili con esiti ischemici) ed ipocinesia della parete infero-laterale. Si segnalava inoltre marcato incremento della trabecolatura a livello della parete libera del VS con rapporto miocardio non compatto/ compatto di circa 5 (v.n.< 2.3). Il ventricolo destro appariva di normali dimensioni, normocontrattile, e non venivano segnalate valvulopatie di rilievo. Il paziente veniva dimesso in condizioni cliniche stabili con indicazione ad eseguire ecocardiogramma color-doppler follow up a circa due mesi dalla dimissione, per valutazione ad eventuale impianto di ICD in prevenzione primaria.
DISCUSSIONE
In letteratura sono riportati rari casi di origine anomala delle coronarie in pazienti con MNC. L’incidenza di anomalie delle coronarie nei pazienti con MNC è sconosciuta, a causa della rarità di entrambe le condizioni. Mattson et al. riportano un caso di un paziente con MNC con origine anomala dell’arteria circonflessa dall’arteria coronaria destra. Questa anomalia coronarica è presente nello 0.37% delle coronarografie, e generalmente non è legata ad un aumentato rischio di morte cardiaca improvvisa9. Secondo le linee guida europee, il MNC in assenza di ulteriori fattori di rischio non rappresenta un’indicazione per l’impianto dell’ICD e per la stratificazione del rischio aritmico bisogna seguire i criteri utilizzati per la cardiomiopatia dilatativa non ischemica10.
L’associazione tra sindrome coronarica acuta (SCA) e MNC è inusuale ed in letteratura sono stati descritti soltanto rari casi di infarto miocardico acuto (IMA) in pazienti con MNC. Nel dettaglio, sono stati descritti sette casi di IMA in pazienti con MNC7,11-16, di cui cinque erano STEMI anteriori in pazienti di sesso maschile ed età compresa tra i 45 ed i 63 anni7,12-15 ed uno era un’IMA in paziente con malattia trivasale sottoposto a CABG16. Panduranga et al., che descrivono un caso di STEMI in paziente con MNC non dislipidemico, ipotizzano che ci possa essere un singolo gene responsabile sia dello sviluppo del miocardio che dell’endotelio coronarico, che potrebbe essere coinvolto nella patogenesi del MNC e allo stesso tempo predisporre ad aterosclerosi coronarica7. E’ stato inoltre descritto da Swinkels et al. un caso di IMA subacuto trattato con CABG in paziente con MNC17. Fettouhi et al. hanno riportato un caso di un paziente con crisi convulsive e successivo riscontro di MNC e IMA apicale18. Salati et al. hanno descritto un caso di arresto cardiaco ed evidenza di malattia trivasale severa alla coronarografia ed insufficienza mitralica e MNC all’ecocardiogramma sottoposto a CABG e valvuloplastica mitralica19. Martini et al. hanno descritto dei casi di MNC familiare associati a dislipidemia familiare e forte familiarità per malattia coronarica documentata, concludendo che l’associazione tra MNC e malattia aterosclerotica coronarica (CAD) potrebbe essere legata alla dislipidemia familiare20. Finsterer et al. hanno descritto un caso di un maschio anziano con MNC, miopatia metabolica e CAD diagnosticata all’esame autoptico21.
In conclusione, il MNC è una condizione fisiopatologica che a volte può associarsi a CAD e meno frequentemente a SCA. Il caso da noi riportato, per la prima volta descrive un MNC in paziente con origine anomala della coronaria circonflessa, complicato da SCA. Ulteriori studi sono necessari per indagare i possibili meccanismi patogenetici che mettono in correlazione il MNC con lo sviluppo di malattia aterosclerotica delle coronarie.
REFERENZE
- Weiford BC, Subbarao VD, Mulhern KM. Noncompaction of the ventricular myocardium. Circulation. 2004 Jun 22;109(24):2965-71. doi: 10.1161/01.CIR.0000132478.60674.D0. PMID: 15210614
- Stöllberger C, Finsterer J. Left ventricular hypertrabeculation/noncompaction. J Am Soc Echocardiogr. 2004 Jan;17(1):91-100. doi: 10.1016/S0894-7317(03)00514-5. PMID: 14712196
- Stollberger C, Winkler-Dworak M, Blazek G, Finsterer J. Left ventricular hypertrabeculation/noncompaction with and without neuromuscular disorders. Int J Cardiol 2004;97:89–92.
- R. Jenni, C.A. Wyss, E.N. Oechslin, P.A. Kaufmann. Isolated ventricular noncompaction is associated with coronary microcirculatory dysfunction. J Am Coll Cardiol, 39 (2002), pp. 450-454
- B.J. Maron, J.A. Towbin, G. Thiene, C. Antzelevitch, D. Corrado, D. Arnett, et al. Contemporary definitions and classification of the cardiomyopathies: an American Heart Association Scientific Statement from the council on clinical cardiology, heart failure and transplantation committee; quality of care and outcomes research and functional genomics and translational biology interdisciplinary working groups; and council on epidemiology and prevention. Circulation, 113 (2006), pp. 1807-1816
- Jenni R, Oechslin E, Schneider J, Attenhofer Jost C, Kaufmann PA. Echocardiographic and pathoanatomical characteristics of isolated left ventricular non-compaction: a step towards classification as a distinct cardiomyopathy. Heart 2001;86:666-71
- Panduranga P, Mukhaini MK. Left-ventricular non-compaction with coronary artery disease. Int J Cardiol. 2011 Jul 1;150(1):e37-9. doi: 10.1016/j.ijcard.2009.09.476. Epub 2009 Oct 24. PMID: 19853934.
- Petersen SE, Selvanayagam JB, Wiesmann F, et al. Left ventricular noncompaction: insights from cardiovascular magnetic resonance imaging. J Am Coll Cardiol 2005;46:101-5
- Mattsson G, Baroudi A, Tawfiq H, Magnusson P. Left ventricular non-compaction cardiomyopathy with coronary artery anomaly complicated by ventricular tachycardia. BMC Cardiovasc Disord. 2017;17(1):263. Published 2017 Oct 16. doi:10.1186/s12872-017-0699-7.
- Priori SG, Blomström-Lundqvist C, Mazzanti A, Blom N, Borggrefe M, Camm J, et al. 2015 ESC guidelines for the Management of Patients with ventricular arrhythmias and the prevention of sudden cardiac death: the task force for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC) Eur Heart J. 2015;36:2793–2867. doi: 10.1093/eurheartj/ehv316.
- Liang JJ, Fenstad ER, Janish CD, Sinak LJ. Left ventricular non-compaction cardiomyopathy: Incidental diagnosis after ST-elevation myocardial infarction. Acute Card Care. 2016 Mar;18(1):25-27. doi: 10.1080/17482941.2016.1234055. Epub 2016 Oct 18. PMID: 27754701
- Gabrielli FA, Lombardo A, Natale L, Galiuto L, Porcelli A, Rebuzzi AG, Crea F. Myocardial infarction in isolated ventricular non-compaction: contrast echo and MRI. Int J Cardiol. 2006 Aug 10;111(2):315-7. doi: 10.1016/j.ijcard.2005.09.054. Epub 2005 Dec 15. PMID: 16343665
- Celik IE, Kilic A, Karadeniz M. Anterior myocardial infarction in a patient with isolated left ventricular non-compaction. Cardiol Young. 2019 May;29(5):708-710. doi: 10.1017/S1047951119000283. Epub 2019 May 2. PMID: 31044686
- Yavuzgil O, Gürgün C, Soydas Cinar C, Yüksel A. Anterior myocardial infarction in an adult patient with left ventricular hypertrabeculation/noncompaction. Int J Cardiol. 2006 Jan 26;106(3):394-5. doi: 10.1016/j.ijcard.2004.12.072. PMID: 16337050
- Correia E, Santos LF, Rodrigues B, Gama P, Cabral C, Santos O. Noncompaction of the myocardium in a patient with acute myocardial infarction. Arq Bras Cardiol. 2010 May;94(5):e62-4, e125-7. English, Portuguese. PMID: 20549028
- Toufan M, Shahvalizadeh R, Khalili M. Myocardial infarction in a patient with left ventricular noncompaction: a case report. Int J Gen Med. 2012;5:661-665. doi:10.2147/IJGM.S28902
- Swinkels BM, Boersma LV, Rensing BJ, Jaarsma W. Isolated left ventricular noncompaction in a patient presenting with a subacute myocardial infarction. Neth Heart J. 2007;15(3):109-111. doi:10.1007/BF03085964
- Fettouhi H, Tamdy A, Ellouali F, Doghmi N, Zarzur J, Cherti M. Crises convulsives révélant une non-compaction du VG compliquée d’un IDM apical [Convulsives crisis revealing left-ventricular non-compaction with apical myocardial infarction]. Ann Cardiol Angeiol (Paris). 2011 Jun;60(3):159-64. French. doi: 10.1016/j.ancard.2010.12.008. Epub 2011 Jan 11. PMID: 21276952.
- Salati M, Di Mauro A, Bregasi A, Mattioli R. Coronary artery bypass graft and mitral valvuloplasty in a patient with isolated ventricular non-compaction. Interact Cardiovasc Thorac Surg. 2010 Sep; 11(3):354-6
- D.B. Martini, C. Sperotto, L. Zhang “Cardiac incidentaloma”: left ventricular non-compaction in kindred with familial coronary artery disease Cardiol J, 14 (2007), pp. 407-410
- Finsterer J, Stollberger C, Bonner E. Left ventricular hypertrabecultion/non-compaction associated with coronary heart disease and myopathy. Int J Cardiol. (2009), doi: 10.1016/j.ijcard.2009.03.007
