Eleonora Guarnieri1, Lorenzo Ridolfi1, Giovanni D. Aquaro2, Raffaele De Caterina1
1 U.O. Cardiologia 1, Azienda Ospedaliero-Universitaria Pisana
2 U.O.C. Imaging Multimodale Cardiovascolare, CNR-Fondazione Toscana Gabriele Monasterio, Pisa
Abstract
Presentiamo il caso di una paziente di 71 anni con leucemia linfatica cronica (LLC) e dolore toracico recidivante inizialmente diagnosticata come miopericardite e successivamente, a seguito dell’esecuzione di esami di secondo livello quali risonanza magnetica cardiaca e TC total body, scoperta essere affetta da neoformazioni miocardiche ed una massa mediastinica risultate essere compatibili con trasformazione della LLC in linfoma aggressivo a grandi cellule B. Si tratta di un singolare caso di sindrome di Richter (RS) che complica meno dell’1% annuo di LLC costituendone una temibile evoluzione. Ancor più infrequente è il coinvolgimento cardiaco. Una diagnosi precoce e un inizio tempestivo della terapia impattano positivamente sulla prognosi.
Caso clinico
Una donna di 71 anni accedeva presso il Pronto Soccorso del nostro ospedale per dolore toracico notturno. Circa cinque anni prima alla paziente era stata diagnosticata una Leucemia Linfatica Cronica (LLC), trattata con inibitore di bcl-2 (venetoclax), ibrutinib, rituximab e bendamustina. Al momento dell’accesso la terapia antineoplastica era stata recentemente sospesa per intolleranza gastroenterica.
Dal colloquio anamnestico si evinceva che la paziente accusava episodi di dolore toracico da circa un mese, provando sollievo con l’inclinazione del busto in avanti.
Agli esami ematochimici si segnalava una formula leucocitaria nei limiti della norma come da buon controllo della malattia linfo-proliferativa, un valore di troponina ad alta sensibilità di 373 ng/L (valori normali inferiori a 14 ng/L), poi di 323 ng/L, PCT negativa, PCR 7 mg/dl. I valori degli indici di flogosi e di miocardiocitonecrosi si sono, poi, mantenuti stabili durante la degenza.
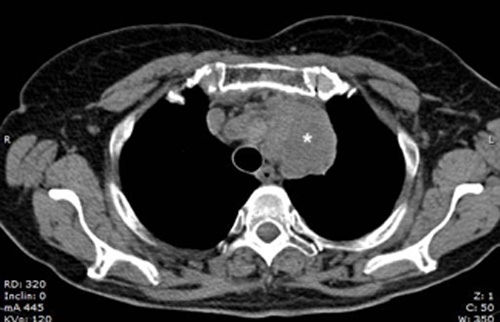
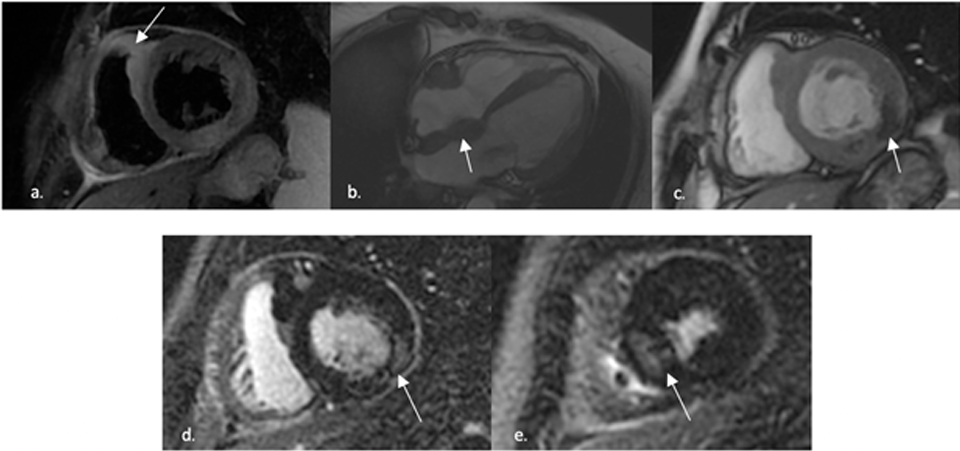
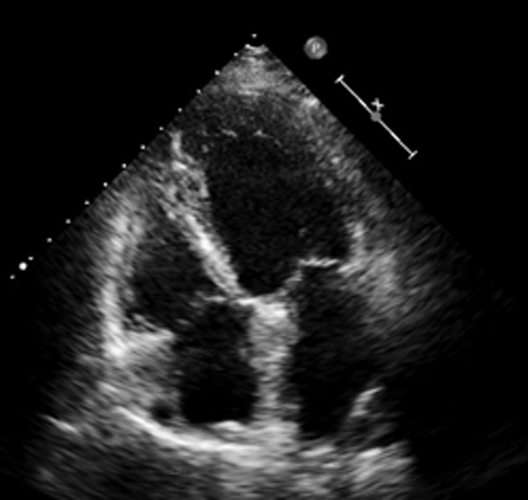
L’ecocardioscopia mostrava ipocinesia infero-laterale e minimo scollamento pericardico circonferenziale con massima separazione dei foglietti pericardici a sede inferiore (7 mm). Allo scopo di escludere una sindrome coronarica acuta, la paziente veniva sottoposta a coronarografia diagnostica, risultata negativa per malattia coronarica ostruttiva. Veniva formulata la diagnosi di mio-pericardite, e si impostava terapia antinfiammatoria con ibuprofene e colchicina. Nel corso della degenza, la paziente accusava severa disfonia, indagata mediante fibrolaringoscopia. Durante l’iter diagnostico, la radiografia del torace evidenziava uno slargamento mediastinico. Allo scopo di chiarire la natura eziologica della mio-pericardite, la paziente veniva sottoposta a risonanza magnetica cardiaca (cRMN), con riscontro di neoformazioni multiple a carico del ventricolo sinistro, della parete libera del ventricolo destro e del setto interatriale. La maggior parte delle neoformazioni si presentava iperintensa nelle sequenze T2-STIR e positive al “late gadolinium enhancement” con valori globalmente aumentati al T1 e T2 mapping. Si apprezzava, inoltre, diffusa iperintensità a carico dei foglietti pericardici associata ancora una volta ad enhancement post-contrastografico tardivo, come da segni di flogosi subacuta (Figura 1). Nel sospetto di evoluzione della LLC la paziente veniva sottoposta a tomografia computerizzata (TC) total body, con riscontro di lesioni multiple in sede cervicale, mediastinica e polmonare bilaterale, e a una successiva biopsia toracoscopica sulla massa più rappresentata, quella in sede mediastinica (Figura 2). L’esame istologico del prelievo concludeva per una localizzazione di linfoma diffuso a grandi cellule di derivazione dai linfociti B periferici (diffuse large B-cell lymphoma, DLBCL), negativi per CD10 e bcl-6 e con espressione immunoistochimica di c-myc e bcl-2. L’attività proliferativa della neoplasia, valutata mediante il marcatore MIB1, risultava elevata (80%). Veniva quindi formulata la diagnosi non comune di evoluzione di LLC in DLBCL, meglio conosciuta come sindrome di Richter (Richter’s syndrome, RS).
Nonostante l’indicazione ematologica a intraprendere una nuova linea di terapia specialistica, la paziente andava incontro a rapido peggioramento delle condizioni generali e a decesso, in accordo con la prognosi altamente infausta tipica della RS.
Discussione
La sindrome di Richter è una rara complicanza della LLC che consiste nella trasformazione della leucemia in un DLBCL aggressivo[1]. Sebbene la LLC sia la più comune tra le leucemie in Europa e negli USA, l’incidenza della RS nei pazienti con LLC è solo dello 0.5-1%/anno[2]. L’intervallo mediano tra la diagnosi di LLC e quella di RS è di 2 anni circa[3].
Una localizzazione cardiaca dei linfomi può essere di tipo primario o secondario; il linfoma cardiaco primario è estremamente raro e rappresenta circa l’1.3-2% di tutte le neoplasie cardiache primitive[4]. Al contrario, il coinvolgimento secondario del cuore in corso di linfoma non-Hodgkin è stato descritto in una maggior percentuale di pazienti, fino al 20% secondo alcuni studi autoptici[5].
La presentazione clinica della RS è spesso eterogenea e aspecifica, e può includere sintomi di scompenso cardiaco (34%), dolore toracico (12%) e/o aritmie (9%)4.
L’ecocardiografia transtoracica (TTE) ha una sensibilità del 60% nell’identificare il coinvolgimento miocardico da parte del linfoma[6]; infatti le immagini acquisite all’ingresso della nostra paziente non hanno da sole destato un forte sospetto di infiltrazione cardiaca (Figura 3). Un esame di secondo livello come TC e/o cRMN si è rivelato in questo senso necessario ai fini di un’accurata definizione anatomica della malattia. La conferma diagnostica della RS deriva, infine, dalla biopsia seguita da esame istologico con caratterizzazione immunoistochimica e di genetica molecolare. Diverso invece è il ruolo dell’ecocardiografia transtoracica nel follow-up terapeutico, in cui la metodica è utile per monitorare l’evoluzione della malattia[7].
Per quanto attiene alla prognosi, i pazienti affetti da linfoma cardiaco aggressivo mostrano un esito sfavorevole con una sopravvivenza media di soli tre mesi; tuttavia, coloro che riescono ad intraprendere precocemente una chemioterapia adeguata e a proseguirla per almeno un mese raggiungono spesso un controllo a lungo termine della malattia, al contrario di chi non beneficia di questa opportunità[hazard ratio (HR) 0.48; intervalli di confidenza al 95% (95% CI) 0.24-0.94; p=0.0264].
Da un’accurata revisione della letteratura ad oggi disponibile sull’argomento risultano soltanto altri due casi descritti di RS con coinvolgimento cardiaco[8],[9]. Per la singolarità della malattia è sembrato utile riportare la nostra esperienza al riguardo. Sebbene di raro riscontro e difficile riconoscimento, la RS “cardiaca” dovrebbe essere considerata nella diagnosi differenziale in pazienti con LLC nota e comparsa improvvisa di sintomi cardiologici. Un approccio di questo genere si rivela indispensabile per un inizio tempestivo della terapia specifica con impatto determinante sulla prognosi.
Bibliografia
[1] Kipps TJ, Stevenson FK, Wu CJ, Croce CM, Packham G, Wierda WG, O’Brien S, Gribben J, Rai K. Chronic lymphocytic leukaemia. Nat Rev Dis Primers. 2017 Feb 9;3:17008.
[2] Rossi D, Cerri M, Capello D, Deambrogi C, Rossi FM, Zucchetto A, De Paoli L, Cresta S, Rasi S, Spina V, Franceschetti S, Lunghi M, Vendramin C, Bomben R, Ramponi A, Monga G, Conconi A, Magnani C, Gattei V, Gaidano G. Biological and clinical risk factors of chronic lymphocytic leukaemia transformation to Richter syndrome. Br J Haematol. 2008 Jun;142(2):202-15.
[3] Parikh SA, Rabe KG, Call TG, Zent CS, Habermann TM, Ding W, Leis JF, Schwager SM, Hanson CA, Macon WR, Kay NE, Slager SL, Shanafelt TD. Diffuse large B-cell lymphoma (Richter syndrome) in patients with chronic lymphocytic leukaemia (CLL): a cohort study of newly diagnosed patients. Br J Haematol. 2013 Sep;162(6):774-82.
[4] Gordon MJ, Danilova O, Spurgeon S, Danilov AV. Cardiac non-Hodgkin’s lymphoma: clinical characteristics and trends in survival. Eur J Haematol. 2016 Nov;97(5):445-452.
[5] McDonnell PJ, Mann RB, Bulkley BH. Involvement of the heart by malignant lymphoma: a clinicopathologic study. Cancer. 1982 Mar 1;49(5):944-51.
[6] Meng Q, Lai H, Lima J, Tong W, Qian Y, Lai S. Echocardiographic and pathological characteristics of cardiac metastasis in patients with lymphoma. Oncol Rep. 2002 Jan-Feb;9(1):85-8.
[7] Maleszewski JJ, Bois MC, Bois JP, Young PM, Stulak JM, Klarich KW. Neoplasia and the Heart: Pathological Review of Effects With Clinical and Radiological Correlation. J Am Coll Cardiol. 2018 Jul 10;72(2):202-227
[8] Zdrenghea M, Bagacean C, Renaudineau Y, Salaun PY, Marin H, Pop D, Tempescul A. Isolated Cardiac Richter Syndrome: a Case Report. Ann Hematol. 2017 Jan;96(1):147-149.
[9] Igala M, Kentos A, Dehou MF, Unger P, Stoupel E, Bron D. Troubles du rythme cardiaque et syndrome cave supérieur révélateurs d’un syndrome de Richter [Cardiac arrhythmias and superior vena cava syndrome revealing a Richter’s syndrome]. Rev Med Brux. 2014 Mar-Apr;35(2):69-71.