Dario Fabiani1, Marco Tontodonato1, Dario Catapano1, Francesco Loffredo1
- Dipartimento di Scienze Mediche Traslazionali, Università degli Studi della Campania “Luigi Vanvitelli”, Ospedale Monaldi, Napoli
Abstract
La miocardite è una malattia infiammatoria del muscolo cardiaco che riconosce diverse cause. Il suo decorso clinico può variare da forme paucisintomatiche fino a casi di shock che necessitano di supporto farmacologico e/o meccanico al circolo1. La mortalità risulta elevata nelle forme a esordio fulminante ed è pertanto necessario un rapido e corretto inquadramento eziologico. Riportiamo il caso clinico di un paziente di 24 anni con riscontro di shock cardiogeno secondario a miocardite fulminante. Il corretto inquadramento clinico-diagnostico e il rapido inizio di una terapia corticosteroidea ad alte dosi sono risultati fondamentali ai fini del miglioramento della prognosi.
Caso Clinico
Presentiamo il caso clinico di un giovane di 24 anni, fumatore, obeso, in assenza di farmaco allergie degne di nota e di familiarità per morte cardiaca improvvisa e/o cardiopatie congenite, fino a quel momento in apparente stato di buona salute. Tale paziente si è presentato al Dipartimento di Emergenza e Accettazione lamentando storia di febbre (T 40°C) da circa 7 giorni, associata a sensazione di malessere generale e dispnea. L’esame obiettivo ha rivelato ipotensione (PA 90/60 mmHg) e linfoadenopatia in sede cervicale, tachicardia (Fc 120 bpm) e tachipnea (Fr 40 atti respiratori/min).
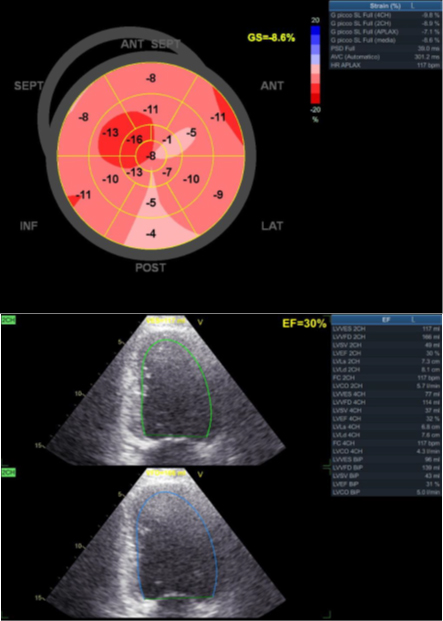
L’ECG mostrava tachicardia sinusale con bassi voltaggi nelle derivazioni periferiche e anomalie diffuse della ripolarizzazione ventricolare. L’emogasanalisi arteriosa evidenziava acidosi metabolica con iperlattacidemia e ipossiemia (SaO2 96% in FiO2 40%). Gli esami di laboratorio eseguiti in urgenza, mostravano una spiccata leucocitosi neutrofila (GB 47.900/mm3 con 94% di neutrofili) e aumentati livelli ematici dei seguenti markers: creatinina, AST/ALT, troponina I ad alta sensibilità, CK-MB massa PCT, PCR e NTpro-BNP. All’ecocardiogramma trans toracico si evidenziava un ventricolo sinistro globalmente ipocinetico con severa riduzione della funzione sistolica globale (FE 30%, GLSa -7,3%, SVi 26 ml/mq) associato a insufficienza mitralica e tricuspidale funzionale di grado moderato, versamento pericardico e vena cava inferiore dilatata e ipocollassante.
È stato inoltre eseguita un’analisi post hoc della funzionalità ventricolare sinistra tramite la tecnica del 2D-speckle tracking echocardiography (2D-STE) che mostrava un ridotto global longitudinal strain (GLS) (Figura 1). Eseguiva inoltre, presso il DEA, TC torace (versamento pleurico in assenza di segni di infiammazione polmonare), TC addome (epatosplenomegalia, linfoadenomegalie in sede lombo-aortica) ed ecografia del collo (multiple linfoadenomegalie confluenti lungo la catena laterocervicale e sopraclaveare sinistra).
Veniva, quindi, trasferito presso la nostra UTIC dove si confermava lo stato emodinamico di shock e dove il paziente veniva sottoposto a monitoraggio invasivo della pressione arteriosa sistemica e della pressione venosa centrale. E’ stato applicato un supporto farmacologico al circolo tramite inotropi (dobutamina endovena) ed è stata introdotta antibioticoterapia empirica ad ampio spettro. Al momento del trasferimento, il paziente presentava un punteggio SOFA pari a 7.
Le emocolture eseguite sono risultate negative. La RT-PCR su tampone naso-faringeo per ricerca del genoma di SARS-CoV2 e dei principali virus respiratori era negativa. Risultavano negativi anche i test sierologici per la ricerca dei seguenti agenti patogeni: parvovirus B19, HBV, HCV, HIV, Toxoplasma, Mycoplasma, Coxsackievirus, Rickettsia, Bartonella, Borrelia, CMV e EBV. I test per dosaggio di ANA, ENA, lupus anticoagulant, anti-dsDNA, anti-cardiolipina, anti-beta2-microglobulina e fattore reumatoide presentavano esito negativo.
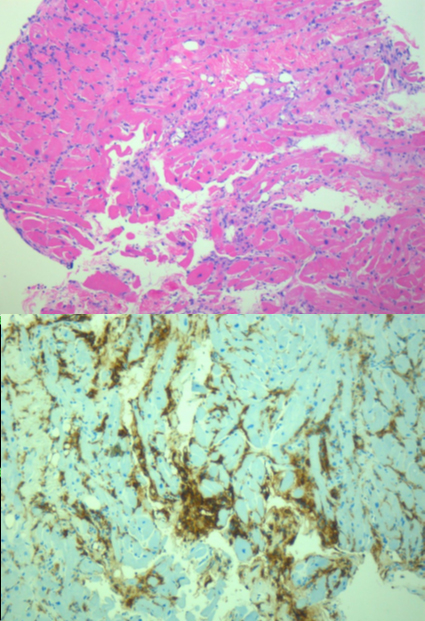
Dopo un giorno dal trasferimento presso la nostra UTIC, in assenza di miglioramento delle condizioni cliniche e dello stato emodinamico di shock, il paziente veniva sottoposto a cateterismo cardiaco destro, che confermava lo stato di bassa gittata con elevati valori di pressione di riempimento post-capillare (PAWP: 15 mmHg). Vista la clinica, in considerazione del sospetto di miocardite, è stata contestualmente eseguita una biopsia endomiocardica del ventricolo destro. L’esame istologico evidenziava la presenza di un infiltrato infiammatorio diffuso con prevalenza di linfociti NK, seguiti da T helper (CD4+) e da sporadici linfociti T soppressori (CD8+) (Figura 2). La RT-PCR praticata sui campioni bioptici risultava negativa per SARS-CoV2, Cytomegalovirus, EBV, HHV6, Parvovirus B-19, Adenovirs ed Enterovirus.
Dopo il riscontro istologico indicativo di infiammazione miocardica e del quadro clinico compatibile con miocardite fulminante, veniva introdotta una terapia corticosteroidea ad elevate dosi con 1.000 mg di metilprednisolone endovena al giorno per 3 giorni consecutivi. In seguito all’inizio della terapia corticosteroidea, si è osservato un rapido ed efficace miglioramento delle condizioni cliniche del paziente e degli esami di laboratorio (livelli ematici di GB, troponine, NTproBNP, AST/ALT, PCR e PCT rientrati nei limiti della norma). A stabilizzazione avvenuta del quadro emodinamico, è stata introdotta una terapia farmacologica anti-scompenso.
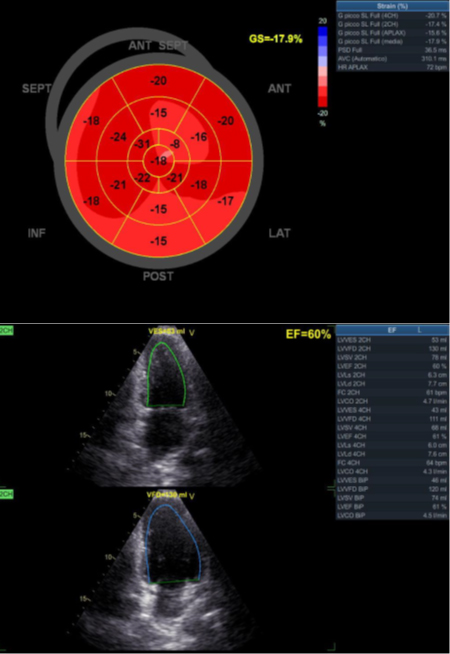
L’ecocardiogramma pre-dimissione (Figura 3) mostrava una completa ripresa della funzione contrattile globale (FE 60%; GLSa -18%), in assenza di segni di congestione centrale e/o periferica.
La cardio-RMN pre-dimissione confermava una normale geometria e contrattilità bi ventricolare. In particolare, non venivano riscontrate aree di elevata intesnsità di segnale nelle sequenze T2 escludendo edema regionale miocardico, mentre si evidenziava un’area di estensione limitata di “late gadolinium enhancement” a distribuzione supepicardica/intramiocardica a livello della parete postero-laterale del ventricolo sinistro (compatibile con danno miocardico di natura non ischemica).
Discussione
La miocardite fulminante è una delle forme di presentazione clinica dell’infiammazione miocardica, che include uno stato di shock cardiogeno con funzione ventricolare severamente ridotta e possibili aritmie maligne. La miocardite inoltre è una causa importante di morte cardiaca improvvisa, rappresentando un burden del 7% dei bambini-giovani adulti e tra il 5 e il 12% nei giovani atleti6. Le cause principali di miocardite/cardiomiopatia infiammatoria includono l’origine infettiva (tra cui prevalgono le infezioni virali), la miocardite immuno-mediata e quella tossica (data da farmaci, metalli pesanti, agenti fisici, ormoni)7. Lo studio dei fattori causali è fondamentale per un corretto inquadramento diagnostico e terapeutico nell’ambito di una patologia la cui gestione è fortemente variabile da paziente a paziente. Nel caso proposto, in seguito a consulenza reumatologica, sulla scorta dei dati clinici, laboratoristici e strumentali è stata, posta diagnosi di malattia di Still dell’adulto (adult onset Still disease, AOSD), una rara patologia infiammatoria sistemica a eziologia sconosciuta.
Il quadro clinico descritto, infatti, rispettava i criteri diagnostici di Yamaguchi2. La diagnosi di AOSD, infatti, è stata posta sulla base della presenza di miocardite, febbre, linfoadenomegalia poli-distrettuale, epatosplenomegalia ed ipertransaminasemia in presenza di test sierologici immunologici e di ricerca di agenti patogeni con esito negativo. La patogenesi della malattia è immuno-mediata, e si basa sulla insorgenza di uno “storm” citochinico (IL-1, IL-6, TNF-α) in soggetti con una predisposizione genetica, che determina uno stato infiammatorio sistemico con coinvolgimento multi-organo3. Sebbene il coinvolgimento cardiaco più frequente sia a carico del pericardio4, è descritto anche un esordio acuto del quadro clinico con insorgenza di miocardite, soprattutto in giovani di sesso maschile5.
Il corretto inquadramento diagnostico multidisciplinare, l’esclusione dello stato settico e il precoce inizio di una terapia corticosteroidea ad elevate dosi sono risultati fondamentali ai fini prognostici.
Dopo 6 mesi di follow-up, il paziente risulta asintomatico con quadro laboratoristico, elettrocardiografico ed ecocardiografico nella norma.
Bibliografia
- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, Burri H, Butler J, Čelutkienė J, Chioncel O, Cleland JGF, Coats AJS, Crespo-Leiro MG, Farmakis D, Gilard M, Heymans S, Hoes AW, Jaarsma T, Jankowska EA, Lainscak M, Lam CSP, Lyon AR, McMurray JJV, Mebazaa A, Mindham R, Muneretto C, Francesco Piepoli M, Price S, Rosano GMC, Ruschitzka F, Kathrine Skibelund A; ESC Scientific Document Group. 2021 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J. 2021 Sep 21;42(36):3599-3726.
- Yamaguchi M, Ohta A, Tsunematsu T, Kasukawa R, Mizushima Y, Kashiwagi H, Kashiwazaki S, Tanimoto K, Matsumoto Y, Ota T, et al. Preliminary criteria for classification of adult Still’s disease. J Rheumatol. 1992 Mar;19(3):424-30.
- Jamilloux Y, Gerfaud-Valentin M, Martinon F, Belot A, Henry T, Sève P. Pathogenesis of adult-onset Still’s disease: new insights from the juvenile counterpart. Immunol Res. 2015 Feb;61(1-2):53-62.
- Bodard Q, Langlois V, Guilpain P, Le Quellec A, Vittecoq O, Noel D, Eble V, Josse S, Schmidt J, Aouba A, Levesque H, Le Besnerais M, Benhamou Y. Cardiac involvement in adult-onset Still’s disease: Manifestations, treatments and outcomes in a retrospective study of 28 patients. J Autoimmun. 2021 Jan;116:102541.
- Gerfaud-Valentin M, Sève P, Iwaz J, Gagnard A, Broussolle C, Durieu I, Ninet J, Hot A. Myocarditis in adult-onset still disease. Medicine (Baltimore). 2014 Oct;93(17):280-289.
- Heymans S, Eriksson U, Lehtonen J, Cooper LT Jr. The Quest for New Approaches in Myocarditis and Inflammatory Cardiomyopathy. J Am Coll Cardiol. 2016 Nov 29;68(21):2348-2364. doi: 10.1016/j.jacc.2016.09.937. PMID: 27884253.
- Caforio AL, Pankuweit S, Arbustini E, Basso C, Gimeno-Blanes J, Felix SB, Fu M, Heliö T, Heymans S, Jahns R, Klingel K, Linhart A, Maisch B, McKenna W, Mogensen J, Pinto YM, Ristic A, Schultheiss HP, Seggewiss H, Tavazzi L, Thiene G, Yilmaz A, Charron P, Elliott PM; European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013 Sep;34(33):2636-48, 2648a-2648d. doi: 10.1093/eurheartj/eht210. Epub 2013 Jul 3. PMID: 23824828.