Marco Micillo1, Rodolfo F. Massafra1, Elisabetta Tonet1
1 Cardiology Unit, Azienda Ospedaliero-Universitaria of Ferrara, Via Aldo Moro 8, Cona, FE, Italy;
ABSTRACT
La morte cardiaca improvvisa (SCD) a genesi aritmica è un argomento di grande interesse sanitario e pone importanti sfide riguardanti la prevenzione primaria e secondaria.
Se quasi sempre l’impianto del defibrillatore è la soluzione terapeutica nella prevenzione secondaria delle aritmie ventricolari in assenza di cause reversibili,[1] è forse più interessante l’approccio in prevenzione primaria, dove per ogni eziologia è importante ricercare dei predittori di rischio aritmico.
Il caso riportato assume interesse per la scarsa disponibilità di predittori di rischio aritmico. Inoltre, permette una disamina sull’importanza dell’imaging multimodale nella SCD abortita, e in generale del lavoro del clinico in quest’era in cui è fondamentale l’integrazione dei dati clinici, laboratoristici e strumentali in un iter diagnostico quanto più sistematizzato e standardizzato
A tal fine vanno caldamente implementati e adoperati nella pratica clinica criteri e score diagnostici possibilmente validati che consentono una definizione più precisa e lineare del processo di diagnosi, dunque di prognosi e di cura.
CASO CLINICO
Presentiamo il caso di una donna di 45 anni, normopeso, con familiarità per cardiopatia ischemica, nessuna terapia domiciliare, nessuna abitudine voluttuaria né familiarità per SCD. In anamnesi riporta morbo di Crohn con singola fase acuta in età giovanile e pregressa emorragia di corpo luteo; nota alla nostra Cardiologia per degenerazione mitralica mixomatosa con prolasso bilembo configurante insufficienza di grado moderato.
Nel mese di Maggio 2022 andava incontro ad arresto cardiaco extra-ospedaliero (OHCA) da fibrillazione ventricolare (FV), trattata mediante manovre rianimatorie, , adrenalina, amiodarone, posizionamento di maschera laringea e ventilazione assistita, ed erogazione di 4 DC-shock. Seguiva ROSC dopo un tempo di arresto di 22 minuti. Al ripristino del ritmo sinusale non emergevano alterazioni del tratto ST e la paziente veniva centralizzata in PS, dove veniva intubata e portata d’urgenza in sala di emodinamica.
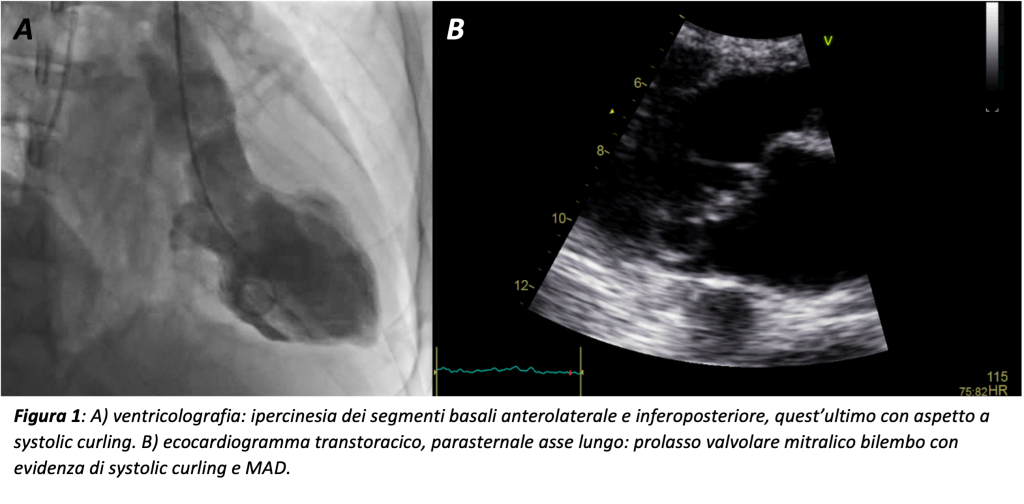
La coronarografia è risultata negativa per lesioni angiograficamente significative, mentre la ventricolografia mostrava ipercinesia dei segmenti basali, ipocinesia dell’apice e dei segmenti medi, quadro compatibile con cardiomiopatia da stress o miocardite acuta. (Figura 1A)
Seguiva ricovero in terapia intensiva (UTI) dove si attuava ipotermia moderata, interrotta 24 ore dopo con regolare risveglio ed estubazione, in assenza di deficit cognitivi e neurologici focali.
L’ecocardiogramma eseguito in seconda giornata documentava dilatazione ventricolare sinistra (VTDi 76 ml/m2) con FE conservata (65%) in assenza di difetti di cinetica segmentaria o apical ballooning, e marcato prolasso mitralico bilembo con insufficienza di grado moderato. (Figura 1B)
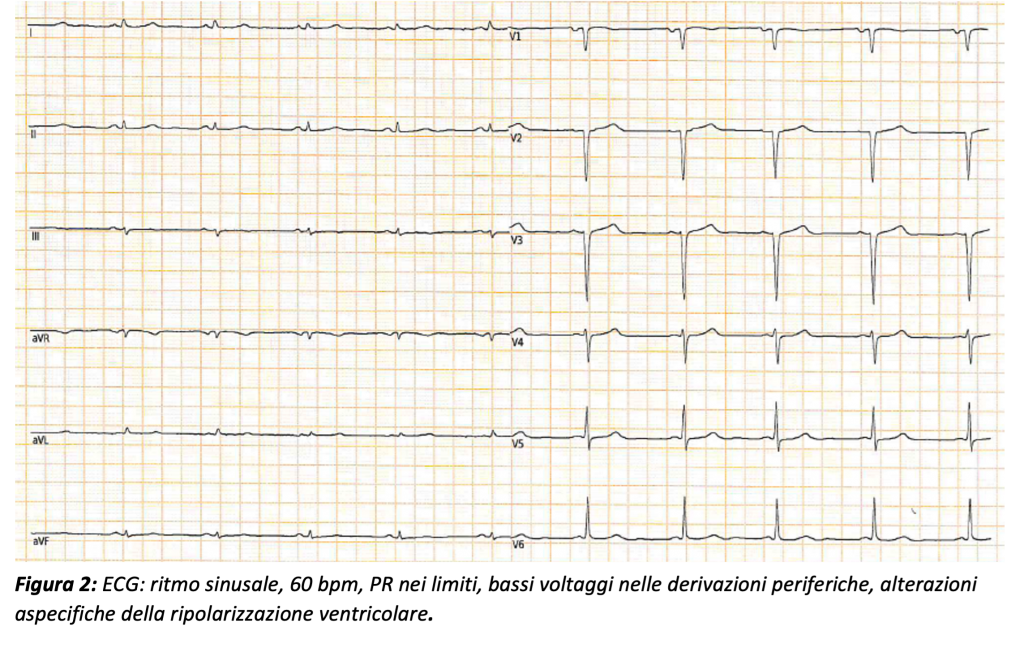
Successivamente la paziente veniva trasferita in UTIC. L’ECG mostrava ritmo sinusale a 80 bpm, PR nei limiti e scarsa crescita dell’onda R, associata a bassi voltaggi nelle derivazioni periferiche. (Figura 2)
La curva di miocardiocitonecrosi mostrava TnI-hs (ng/L): 24 (1° giornata) 143 (2° giornata) 28 (4° giornata); emocromo, elettroliti, funzione epatica, renale e tiroidea, e PCR risultavano nei limiti.
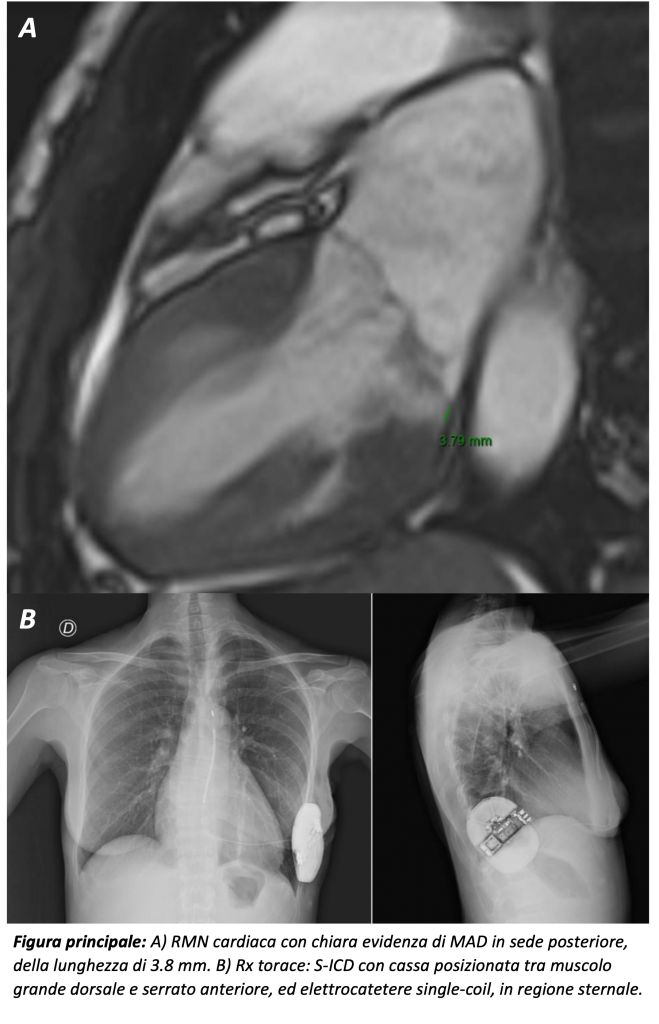
Seguiva approfondimento diagnostico mediate risonanza magnetica cardiaca (CMR) che riscontrava ventricolo sinistro ai limiti superiori (EDV/BSA 106 ml/m2), FE nei limiti, prolasso mitralico bilembo e disgiunzione anulo-mitralica (MAD) di 3.8 mm, con curling sistolico e pseudoipertrofia della parete infero-laterale basale, con sfumato mid-enhancement. Non alterazioni in T1 mapping pre e post-contrastografico. Minimo diffuso edema dei segmenti medio-apicali in T2-W e T2 mapping. Esile versamento pericardico ubiquitario. (Figura principale, A)
Durante la degenza non si evidenziavano eventi aritmici alla telemetria cardiaca.
Discusso il caso collegialmente, si escludevano le ipotesi di miocardite acuta e cardiomiopatia da stress, ritenendo il quadro imputabile in prima istanza a MAD aritmica. Considerata la giovane età della paziente, la mancata necessità di pacing e il quadro aritmico d’esordio con FV, si riteneva opportuno impianto di defibrillatore cardiaco sottocutaneo (S-ICD) in prevenzione secondaria. La paziente veniva dimessa con terapia betabloccante, in buon compenso cardiocircolatorio, e parametri ottimali del dispositivo. (Figura principale, B)
DISCUSSIONE
In seguito ad un OHCA da FV, esclusa la sindrome coronarica acuta, prima causa epidemiologica nella popolazione generale,1 è importante soprattutto nel giovane indagare cardiomiopatie e canalopatie.
L’anamnesi familiare negativa, l’assenza di alterazioni ECG suggestive o di fattori scatenanti come stress fisici o emotivi (LQT1, CPVT), stimoli sensoriali improvvisi (LQTS2), farmaci o febbre (sindrome di Brugada), ha fugato l’ipotesi di canalopatia.
Il primo sospetto diagnostico, data anche la netta prevalenza femminile, è scaturito dalla ventricolografia suggestiva di sindrome di Takotsubo, il cui esordio aritmico è raro ma documentato.[2],[3],[4] Nonostante fosse rispettato il criterio diagnostico InterTAK di alterazione di cinetica a distribuzione non coronarica,[5] la diagnosi veniva ritenuta poco probabile innanzitutto per l’inverosimile rapidissima reversibilità della stessa alterazione della cinetica, già in seconda giornata, e inoltre per il modesto incremento degli indici di miocardiocito-necrosi.
La diagnosi di miocardite risultava improbabile per l’andamento della curva di miocardiocito-necrosi, la negatività degli indici di flogosi, assenza di febbre e segni di infezione recente, o esposizione a farmaci o tossici. Pertanto, malgrado a favore dell’ipotesi sussistesse una storia di malattia infiammatoria extracardiaca (morbo di Crohn, tuttavia al momento silente), stante il basso sospetto diagnostico, non sono stati intrapresi ulteriori approfondimenti diagnostici.[6],[7],[8]
Infine, la CMR risultava poco suggestiva per eziologie strutturali quali cardiomiopatia ipertrofica[9] cardiomiopatia aritmogena[10] e sarcoidosi[11]. Tuttavia, emergeva il reperto occasionale di una modesta ma chiara MAD, con discreto agreement con l’ecocardiografia transtoracica.[12]. [Figura 1A]
La MAD è un’anomala separazione della giunzione tra valvola mitrale e miocardio ventricolare. Essa può associarsi a prolasso valvolare, nell’ambito del quale si riscontra dal 15-55% dei casi.[13]
Il reperto si associa a un rischio aritmico la cui fisiopatologia è stata ricondotta alla trazione che l’apparato valvolare prolassante esercita sui papillari, in particolare sul postero-mediale, nonché sull’anello mitralico, producendo fenomeni di infiammazione e/o ischemia, con fibrosi secondaria. La trazione sul miocardio papillare e sul tessuto del Purkinje circostante è stata identificata inoltre come causa di attività triggerata alla base delle aritmie ventricolari maligne.[14],[15],[16]
Le evidenze in letteratura concordano variabilmente su alcuni predittori di rischio quali giovane età, precedenti sincopi, frequenti extrasistoli ventricolari,[17] presenza di prolasso valvolare, onde T invertite in regione infero-laterale, fibrosi dei muscoli papillari, fibrosi in regione posterolaterale, e ampiezza della MAD.[18],[19]
È importante sottolineare che la MAD aritmica è attualmente una diagnosi di esclusione, non contemplata dalle maggiori linee guida su aritmie ventricolari e SCD,1,[20] e come tale è stata formulata nella nostra paziente. La sua gestione è ancor meno definita. I pazienti che sviluppano un’aritmia ventricolare vanno incontro ad impianto di ICD in prevenzione secondaria, secondo linee guida, mentre al momento non vi è un orientamento codificato circa la prevenzione primaria.
CONCLUSIONI
Il caso riportato assume interesse per la scarsa disponibilità di predittori di rischio aritmico. Inoltre, ci permette una disamina sull’importanza dell’imaging multimodale nella SCD abortita, e in generale del lavoro del clinico in quest’era in cui è fondamentale l’integrazione dei dati clinici, laboratoristici e strumentali in un iter diagnostico quanto più sistematizzato e standardizzato, procedendo per esclusione in primis delle patologie a maggiore probabilità pre-test nel sottotipo di paziente, secondo logica bayesiana, poi di quelle per cui è possibile esprimere una diagnosi di certezza o quantomeno di presunzione. A tal fine vanno caldamente implementati e adoperati nella pratica clinica criteri e score diagnostici possibilmente validati, che consentono una definizione più precisa e lineare del processo di diagnosi, dunque di prognosi e di cura.
Referenze
[1] Priori SG, Blomström-Lundqvist C, Mazzanti A, et al. 2015 ESC Guidelines for the management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: The Task Force for the Management of Patients with Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death of the European Society of Cardiology (ESC). Endorsed by: Association for European Paediatric and Congenital Cardiology (AEPC). Eur Heart J. 2015;36(41):2793-2867. doi:10.1093/eurheartj/ehv316
[2] Bortnik M, Verdoia M, Schaffer A, Occhetta E, Marino P. Ventricular fibrillation as primary presentation of takotsubo cardiomyopathy after complicated cesarean delivery. World J Cardiol. 2012;4(6):214-217. doi:10.4330/wjc.v4.i6.214
[3] Habedank D, Thieme R, Bublak A, Heinemann F, Spencker S, Atmowihardjo I. Ventricular fibrillation and Takotsubo cardiomyopathy triggered by media panic on COVID-19: A case report [published online ahead of print, 2020 Dec 3]. Clin Case Rep. 2020;9(1):72-76. doi:10.1002/ccr3.3423
[4] Kurisu S, Inoue I, Kawagoe T, et al. Tako-tsubo cardiomyopathy after successful resuscitation of out-of-hospital cardiac arrest. J Cardiovasc Med (Hagerstown). 2010;11(6):465-468. doi:10.2459/jcm.0b013e3283339eb9
[5] Ghadri JR, Wittstein IS, Prasad A, et al. International Expert Consensus Document on Takotsubo Syndrome (Part I): Clinical Characteristics, Diagnostic Criteria, and Pathophysiology. Eur Heart J. 2018;39(22):2032-2046. doi:10.1093/eurheartj/ehy076
[6] Rose NR. Myocarditis: infection versus autoimmunity. J Clin Immunol. 2009;29(6):730-737. doi:10.1007/s10875-009-9339-z
[7] Belin RJ, Ghasemiesfe A, Carr J, Miller FH, Parada C, Akhter N. Crohn’s colitis-induced myocarditis. J Cardiol Cases. 2016;14(1):4-7. Published 2016 Apr 7. doi:10.1016/j.jccase.2016.03.007
[8] Oh IS, Choi CH, Park JH, et al. A case of acute myocarditis as the initial presentation of Crohn’s disease. Gut Liver. 2012;6(4):512-515. doi:10.5009/gnl.2012.6.4.512
[9] Authors/Task Force members, Elliott PM, Anastasakis A, et al. 2014 ESC Guidelines on diagnosis and management of hypertrophic cardiomyopathy: the Task Force for the Diagnosis and Management of Hypertrophic Cardiomyopathy of the European Society of Cardiology (ESC). Eur Heart J. 2014;35(39):2733-2779. doi:10.1093/eurheartj/ehu284
[10] Corrado D, Perazzolo Marra M, Zorzi A, et al. Diagnosis of arrhythmogenic cardiomyopathy: the Padua criteria. Int J Cardiol 2020;319:106–14.
[11] Birnie DH, Sauer WH, Bogun F, et al. HRS expert consensus statement on the diagnosis and management of arrhythmias associated with cardiac sarcoidosis. Heart Rhythm. 2014;11(7):1305-1323. doi:10.1016/j.hrthm.2014.03.043
[12] Mantegazza V, Volpato V, Gripari P, et al. Multimodality imaging assessment of mitral annular disjunction in mitral valve prolapse. Heart. 2021;107(1):25-32. doi:10.1136/heartjnl-2020-317330
[13] Chakrabarti AK, Bogun F, Liang JJ. Arrhythmic Mitral Valve Prolapse and Mitral Annular Disjunction: Clinical Features, Pathophysiology, Risk Stratification, and Management. J Cardiovasc Dev Dis. 2022;9(2):61. Published 2022 Feb 16. doi:10.3390/jcdd9020061
[14] Basso, C.; Iliceto, S.; Thiene, G.; Perazzolo Marra, M. Mitral valve prolapse, ventricular arrhythmias, and sudden death. Circulation 2019, 140, 952–964.
[15] Lee, A.; Hamilton-Craig, C.; Denman, R.; Haqqani, H.M. Catheter ablation of papillary muscle arrhythmias: Implications of mitral valve prolapse and systolic dysfunction. Pacing Clin. Electrophysiol. 2018, 41, 750–758.
[16] Santoro, F.; Di Biase, L.; Hranitzky, P.; Sanchez, J.E.; Santangeli, P.; Perini, A.P.; Burkhardt, J.D.; Natale, A. Ventricular fibrillation triggered by PVCs from papillary muscles: Clinical features and ablation. J. Cardiovasc. Electrophysiol. 2014, 25, 1158–1164.
[17] Essayagh, B.; Sabbag, A.; Antoine, C.; Benfari, G.; Yang, L.-T.; Maalouf, J.; Asirvatham, S.; Michelena, H.; Enriquez-Sarano, M. Presentation and outcome of arrhythmic mitral valve prolapse. J. Am. Coll. Cardiol. 2020, 76, 637–649.
[18] Bennett S, Thamman R, Griffiths T, et al. Mitral annular disjunction: A systematic review of the literature. Echocardiography. 2019;36(8):1549-1558. doi:10.1111/echo.14437
[19] Oliveri, F.; Kakargias, F.; Panday, P.; Arcia Franchini, A.P.; Iskander, B.; Anwer, F.; Hamid, P. Arrhythmic mitral valve prolapse: Diagnostic parameters for high-risk patients: A systematic review and meta-analysis. Pacing Clin. Electrophysiol. 2021
[20] Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS Guideline for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death: Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society [published correction appears in Circulation. 2018 Sep 25;138(13):e415-e418]. Circulation. 2018;138(13):e210-e271. doi:10.1161/CIR.0000000000000548