Matteo Bertini, MD, PhD1, Francesco Vitali, MD1, Luca Santini, MD2, Vincenzo Tavoletta, MD3, Angelo Giano, MD4, Gianluca Savarese, MD5, Antonio Dello Russo, MD6, Vincenzo Ezio Santobuono, MD7, Agostino Mattera, MD8, Carlo Lavalle, MD9, Claudia Amellone, MD10, Domenico Pecora, MD11, Raimondo Calvanese, MD12, Antonio Rapacciuolo, MD13, Monica Campari, MS14, Sergio Valsecchi, PhD14, Leonardo Calò, MD15,
Affiliazioni:
1Cardiology Unit, Sant’Anna University Hospital, University of Ferrara, Ferrara, Italy,
2“Giovan Battista Grassi” Hospital, Rome, Italy,
3Unità Operativa di Elettrofisiologia, Studio e Terapia delle Aritmie”, Monaldi Hospital, Naples, Italy,
4OO.RR. San Giovanni di Dio Ruggi d’Aragona, Salerno, Italy
5S. Giovanni Battista Hospital, Foligno, Italy,
6Clinica di Cardiologia e Aritmologia, Università Politecnica delle Marche, “Ospedali Riuniti”, Ancona, Italy, 7University of Bari, Policlinico di Bari, Bari, Italy,
8S. Anna e S. Sebastiano Hospital, Caserta, Italy,
9Policlinico Umberto I, Rome, Italy,
10 ”Maria Vittoria” Hospital, Turin, Italy,
11Fondazione Poliambulanza, Brescia, Italy,
12Ospedale del Mare, ASL NA1, Naples, Italy,
13Policlinico Federico II, Naples, Italy,
14Boston Scientific Italia, Milan, Italy,
15Policlinico Casilino, Rome, Italy.
Commento di:
Rodolfo Francesco Massafra, Federico Gibiino, Alberto Boccadoro. Cardiology Unit, Sant’Anna University Hospital, University of Ferrara, Ferrara, Italy.
ABSTRACT
La fibrillazione atriale (FA) è frequente e prognosticamente impattante nel paziente con scompenso cardiaco (SC).[1] Tra queste due condizioni cliniche vi è un profondo e complesso legame bidirezionale basato su vie fisiopatologiche comuni. La diagnostica dei dispositivi cardiaci impiantabili permette di valutare l’insorgenza di FA subclinica, registrata come episodi di elevata frequenza atriale (AHRE) e la progressione del suo burden giornaliero. Inoltre, alcuni defibrillatori forniscono algoritmi di valutazione del compenso cardiocircolatorio efficaci nel predire episodi di SC con anticipo.[2]
Nel nostro studio abbiamo valutato l’associazione tra valori dell’indice HeartLogic come surrogato del compenso cardiocircolatorio e l’incidenza di FA subclinica valutata attraverso l’incidenza di AHRE.
COMMENTO
L’impatto prognostico peggiorativo dell’FA nello SC è ben noto. Oggi alcuni defibrillatori hanno a disposizione algoritmi in grado di anticipare l’insorgenza di SC. Inoltre, dispositivi con elettrocatetere atriale, sono in grado di registrare AHRE.
Il nostro è uno studio di registro multicentrico che ha arruolato pazienti con ICD o CRT-D con SC e FE ventricolare sinistra ≤35%. All’arruolamento è stato attivato HeartLogic, un algoritmo multiparametrico (frequenza cardiaca, primo e terzo tono, frequenza respiratoria, impedenza transtoracica, attività del paziente) di monitoraggio del compenso cardiocircolatorio, che fornisce un punteggio giornaliero e attiva un allarme di rischio di SC quando supera una certa soglia (valore nominale 16). Questo allarme è relato a rischio aumentato di episodi di SC a 30 giorni. È stato inoltre valutato il burden di AHRE, validati da parte di un elettrofisiologo, con incidenza cumulativa nel periodo di follow-up ≥5 minuti/die, ≥6 ore/die e ≥23 ore/die.
Sono stati valutati 568 pazienti per un follow-up di 25 mesi. L’indice HeartLogic superava il valore soglia 1200 volte (0.71 alert per paziente-anno) in 370 pazienti. Il tempo mediano IN-alert era il 7%. Il burden di FA subclinico giornaliero ≥5 minuti/die era documentato in 183 pazienti (32%), ≥6 ore/die in 118 pazienti (21%) e ≥23 ore/die in 89 pazienti (16%).
Una regressione multivariata tempo-dipendente aggiustata per le variabili cliniche associate allo sviluppo di AHRE all’univariata ha esaminato come covariata di interesse la media settimanale dell’indice HeartLogic nei periodi di allarme attivo (IN-alert) e inattivo (OUT-of-alert).
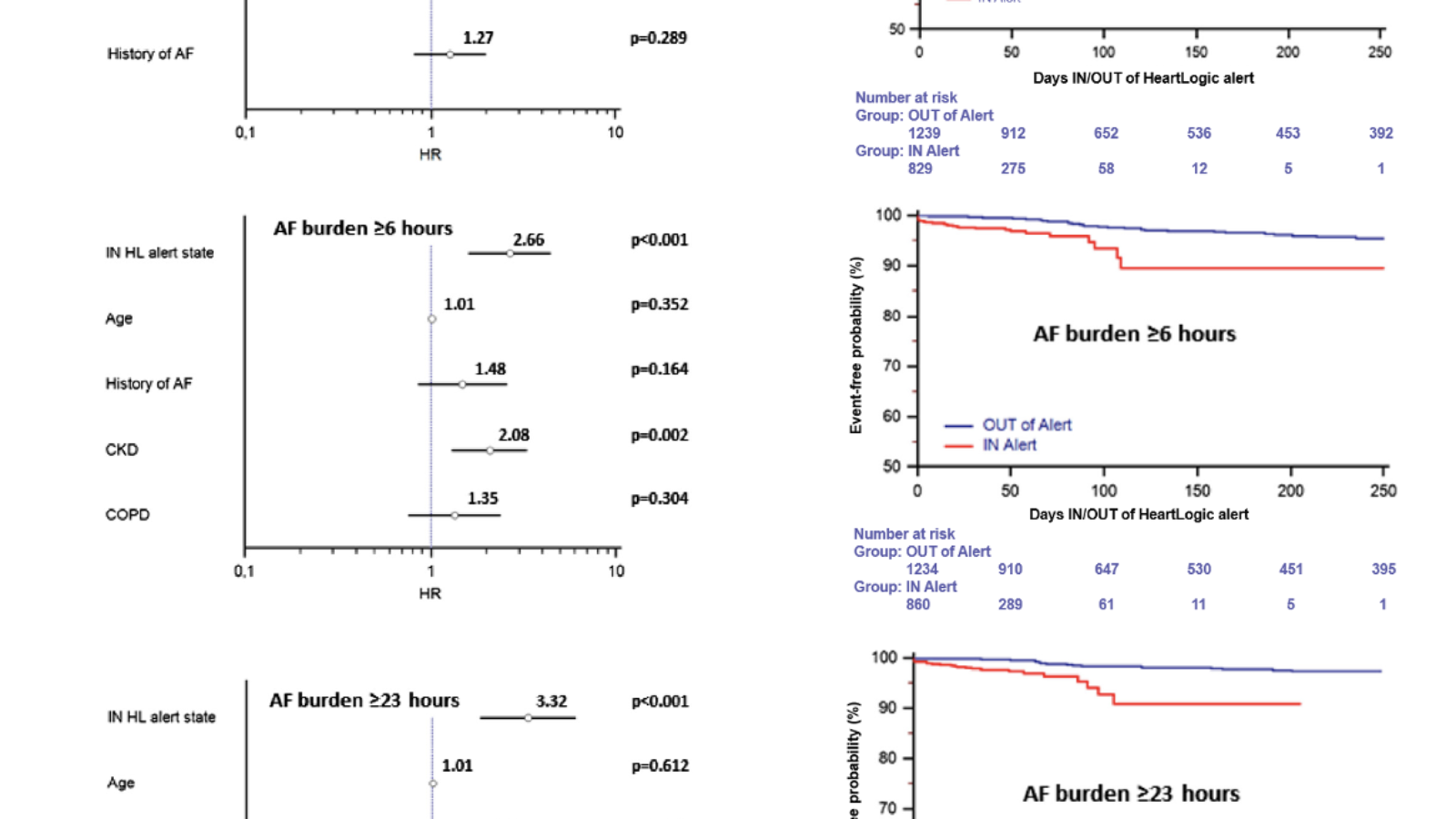
All’analisi multivariata lo stato IN-alert risultava indipendentemente associato con un burden di FA ≥5 minuti/die (HR 1.95, 95% CI 1.22–3.13; P = .005), ≥6 ore/die (HR 2.66, 95% CI 1.60–4.44; P <.001), e ≥23 ore/die (HR 3.32, 95% CI 1.83–6.02; P <.001), dopo correzione per età, storia di FA pregressa, insufficienza renale cronica e pneumopatia [Figura 1A].
Inoltre, comparando i burden di FA subclinica durante stato IN-alert rispetto ad OUT-of-alert all’analisi multivariata, l’HR era 1.57 (95% CI 1.04–2.50, P = .042) per un burden ≥5 minuti/die, 2.06 (CI 1.22–3.47, P = .007) per ≥6 ore/die e 3.11 (95% CI 1.73–5.57 (P< .001) per ≥23 ore/die. L’associazione temporale col primo episodio di allarme era già presente per burden di FA ≥5 minuti/die e aumentava al crescere del burden [Figura 2].
Con il nostro studio abbiamo dimostrato come lo stato di allerta dell’indice risultava associato indipendentemente con sviluppo di FA subclinica con una relazione bidirezionale. L’algoritmo in studio inoltre mostra capacità di stratificazione dinamica del rischio di FA subclinica nel paziente con SC. Lo stato IN-alert identificava indipendentemente pazienti 2-3 volte più a rischio di FA. Viceversa, anche il riconoscimento di AHRE si associava ad allarme per SC. Recenti evidenze mostrano l’efficacia degli interventi farmacologici guidati da allarme di scompenso cardiaco di ICD/CRT-D su tasso e durata degli episodi di SC.[3] Dal monitoraggio dei dispositivi potrebbe in futuro emergere il ruolo di tali trattamenti anche sull’insorgenza e sulla riduzione del burden di FA, rafforzando il ruolo ben noto della terapia upstream sulla progressione della patologia, così come potrebbe evidenziare il ruolo delle strategie di controllo del ritmo sugli outcome di SC.
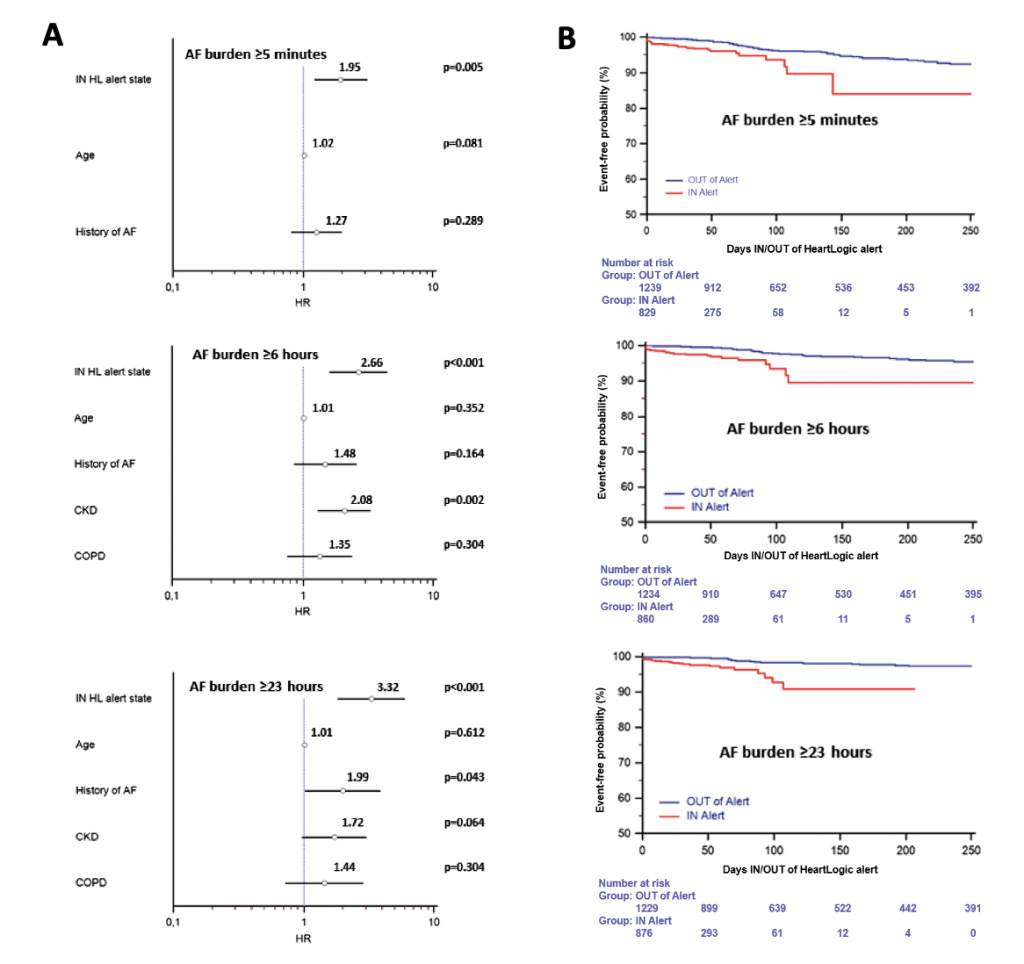
Figura 1 (Figura chiave)
- Analisi di regressione di Cox: associazione tra lo stato settimanale IN-alert e burden di FA ≥5 minuti/giorno, ≥6 ore/giorno e ≥23 ore/giorno, dopo aggiustamento per variabili cliniche. CKD = insufficienza renale cronica; COPD = broncopneumopatia cronica ostruttiva.
- Curva di Kaplan-Meier: tempo al primo AHRE secondo i burden di FA analizzati (≥5 minuti/giorno, ≥6 ore/giorno e ≥23 ore/giorno) negli stati IN-alert e OUT-of-alert.
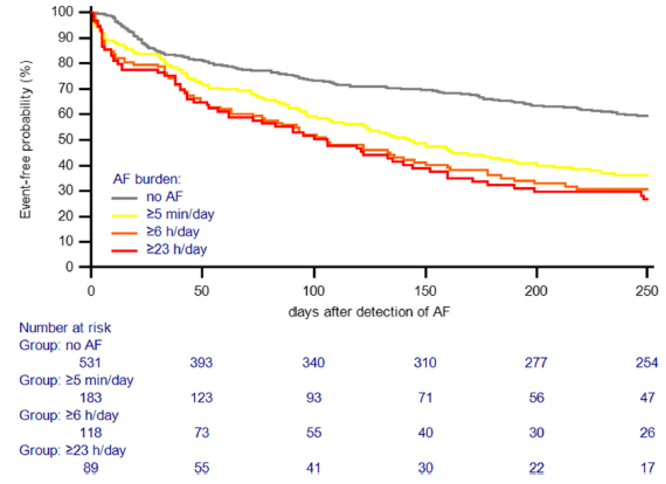
Figura 2
Curva di Kaplan–Meier: tempo al primo alert HeartLogic dopo riconoscimento di un burden di FA rispettivo ≥5 minuti/giorno, ≥6 ore/giorno e ≥23 ore/giorno. Il Gruppo senza FA è mostrato per comparazione. AF = fibrillazione atriale; AHRE = episodi di elevate frequenza atriale
Per saperne di più:
Bertini M, Vitali F, Santini L, Tavoletta V, Giano A, Savarese G, Russo AD, Santobuono VE, Mattera A, Lavalle C, Amellone C, Pecora D, Calvanese R, Rapacciuolo A, Campari M, Valsecchi S, Calò L. Implantable defibrillator-detected heart failure status predicts atrial fibrillation occurrence. Heart Rhythm. 2022 May;19(5):790-797. doi: 10.1016/j.hrthm.2022.01.020. Epub 2022 Jan 20. PMID: 35066184.
Figure ristampate e modificate da: Heart Rhythm, Vol 19, No 5, May 2022, pages 790-797.
BIBLIOGRAFIA:
[1] Wang TJ, Larson MG, Levy D, et al. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation 2003;107:2920–2925.
[2] Boehmer JP, Hariharan R, Devecchi FG, et al. A multisensor algorithm predicts heart failure events in patients with implanted devices: results from the Multi-
SENSE study. JACC Heart Fail 2017;5:216–225.
[3] Hernandez A, Albert N, Allen L, et al.Multiple cardiac sensors for management of heart failure (MANAGE-HF)-Phase I. Eur J Heart Fail 2021;23(SupplS2):159.