Autori: Alice Bonanni 1,2,† , Alessia d’Aiello 1,2,†, Daniela Pedicino 1,2,*, Marianna Di Sario 1, Ramona Vinci 1,2 , Myriana Ponzo 1 , Pellegrino Ciampi 1, Denise Lo Curto 1, Cristina Conte 1, Francesco Cribari 1, Francesco Canonico 2 , Giulio Russo 1,2, Rocco Antonio Montone 1,2, Carlo Trani 1,2, Anna Severino 1,2, Filippo Crea 1,2 and Giovanna Liuzzo 1,2
Affiliazioni
1 Dipartimento di Scienze Cardiovascolari e Polmonari, Università cattolica del Sacro Cuore ,00168 Roma, Italia
2 Dipartimento di Scienze Cardiovascolari, Fondazione Policlinico Universitario Agostino Gemelli IRCCS, 00168 Rome, Italia;
† Questi autori hanno contribuito equamente alla stesura del paper
Fino al 50% dei pazienti sottoposti ad angiografia coronarica per angina non presentano malattia coronarica ostruttiva (1). Nonostante l’aspetto angiografico possa risultare rassicurante, sempre maggiori evidenze dimostrano che, in realtà, la prognosi di tale classe di pazienti non è così benigna (2).
Al momento attuale mancano linee guida internazionali concordi sulla diagnosi e sul trattamento dei pazienti con ischemia ed assenza di malattia coronarica ostruttiva (INOCA); è ragionevole quindi pensare che spesso tali pazienti non vengano correttamente individuati e, quindi, trattati.
Trentotto pazienti sintomatici per angina e ricoverati presso il nostro Nosocomio in regime di elezione sono stati arruolati prospettivamente e sottoposti a prelievo di sangue venoso periferico e studio coronarografico. Cellule mononucleate isolate da materiale biologico sono state sottoposte ad analisi array di espressione genica. I pazienti sono stati suddivisi in due gruppi in base ai risultati della coronarografia. In particolare, diciotto pazienti presentavano assenza di malattia coronarica ostruttiva e venti pazienti avevano malattia coronarica ostruttiva.
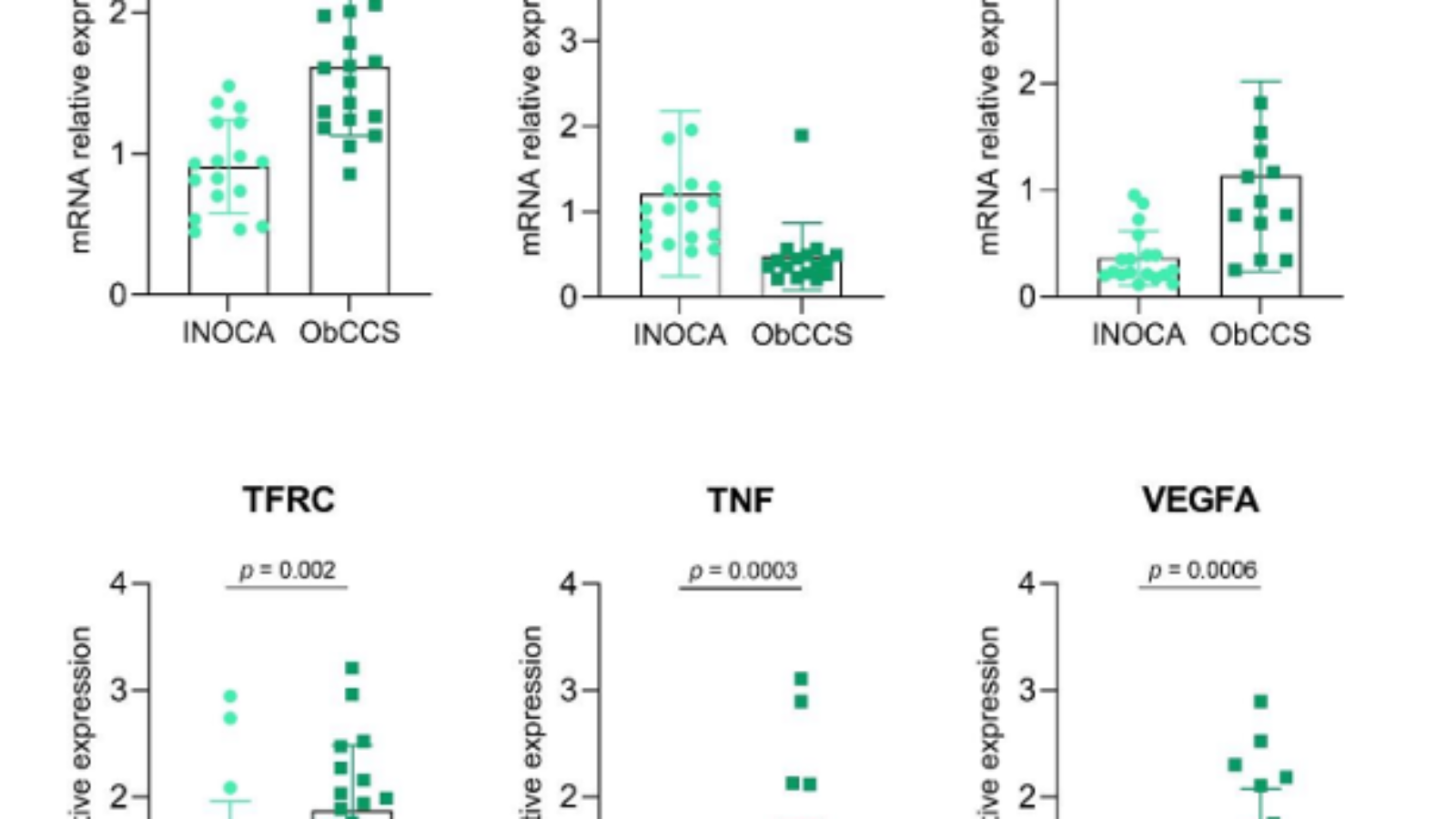
Nei pazienti con disfunzione microvascolare è stata osservata una ridotta produzione di molecole infiammatorie coinvolte nell’adesione cellulare (quali TNF, fattore di necrosi tumorale; VEGFA, fattore di crescita dell’endotelio vascolare A; CD31, Molecola di adesione delle piastrine e delle cellule endoteliali 1; ICAM1 e VCAM 1, Molecola di Adesione Intercellulare 1 e Vascolare) e nella risposta infiammatoria pro-aterogena (tra cui TFRC, recettore della transferrina).
L’aumentata produzione di TNF potenzia l’espressione di molecole di adesione vascolare e, a sua volta, induce la proliferazione e la trasmigrazione cellulare, noti fenomeni alla base della formazione e della crescita della placca aterosclerotica (3). Il VEGFA lavora simultaneamente al TNF stimolando la proliferazione e l’arrivo di cellule infiammatorie a livello dell’intima vascolare (4); molecole di adesione quali CD31 e ICAM1 consentono il recruitment, la transmigrazione vascolare e l’entrata dei leucociti a livello della tonaca vascolare (5; 6). Anche i livelli di espressione genica dei recettori della transferrina responsabili dell’uptake del ferro intracellularmente, sono risultati alterati; ad essi viene imputata una plausibile tossicità mitocodriale ferro-relata, che esita in un’ aumentata produzione di specie radicaliche ed ossitative e nella progressione dello stato infiammatorio locale e sistemico (7;8).
Parallelamente, in tali pazienti è stata evidenziata un’aumentata espressione genica di Ialuronidasi 2 (HYAL 2), una proteina implicata nel turnover della matrice extracellulare e nel metabolismo dell’acido ialuronico.
HYAL2 è una proteina nota ed ampiamente studiata nel contesto dello shear stress vascolare e nel meccanismo dell’erosione di placca aterosclerotica (9;10); di contro non ci sono ancora evidenze del suo ruolo nella disfunzione microcircolatoria.
Il principale meccanismo patogenetico degli INOCA è rappresentato dalla disfunzione dell’endotelio e delle cellule muscolari lisce; in tale setting, l’endotelina-1 (EDN1), attivando a valle una risposta infiammatoria e un disequilibrio ossidativo, ne risulta essere la principale responsabile (11;12;13). In aggiunta ad essa, lo stress di parete, co-responsabile della disfunzione microcircolatoria, induce la distruzione HYAL-mediata della matrice cellulare e tale meccanismo potrebbe spiegare almeno in parte la genesi e la progressione della disfunzione microcircolatoria, sino alla riduzione della riserva di flusso coronarica. Le alterazioni del flusso coronarico locale potrebbero essere, infatti, uno stimolo aggiuntivo pro-infiammatorio che elicita l’espressione di HYAL2, responsabile a sua volta dell’ampliazione del danno (11,12).
Conclusioni: In base alle evidenze attuale, l’unico strumento diagnostico disponibile per distinguere pazienti affetti da angina con malattia coronarica ostruttiva versus non ostruttiva è l’angiografia coronarica con valutazione emodinamica del circolo coronarico ed i test di vasoreattività. Le profonde differenze molecolari tra i due gruppi di pazienti emerse nel nostro studio, oltre a chiarire i meccanismi fisiopatologici sottesi, potrebbero consentire una diagnosi differenziale precoce e non invasiva.

Figura 1. L’ Istogramma mostra e confronta i livelli di espressione genica delle molecole in esame nei due gruppi di pazienti (INOCA Vs ObCCS).
INOCA = ischemia in assenza di malattia coronarica ostruttiva
ObCCS = sindrome coronarica cronica ostruttiva
ADAMTS13 = ADAM Metallopeptidasi con Trombospondina Tipo 1 Motivo 13; ALOX5 = Arachidonato 5-Lipossigenasi; CD31 = Molecola di adesione delle piastrine e delle cellule endoteliali 1; CD44 = recettore ialuronico; EDN1 = Endotelina 1; GPX1 = Glutatione perossidasi 1; HYAL2 = Ialuronidasi 2; ICAM1 = Molecola di Adesione Intercellulare 1; LGALS8 = Galectina 8; MMP1 = metalloproteinasi di matrice 1; MMP2 = matrice metalloproteinasi 2; MMP9 = metalloproteinasi della matrice 9; NOS3 = ossido nitrico sintasi endoteliale; PI16 = inibitore della peptidasi 16; PLA2G7 = fosfolipasi A2 gruppo VII; SOD1 = Superossido dismutasi 1; TFRC = recettore della transferrina; TIMP1 = TIMP Inibitore della metallopeptidasi 1; TNF = fattore di necrosi tumorale; VCAM1 = Molecola di adesione delle cellule vascolari 1; VEGFA = fattore di crescita dell’endotelio vascolare A.
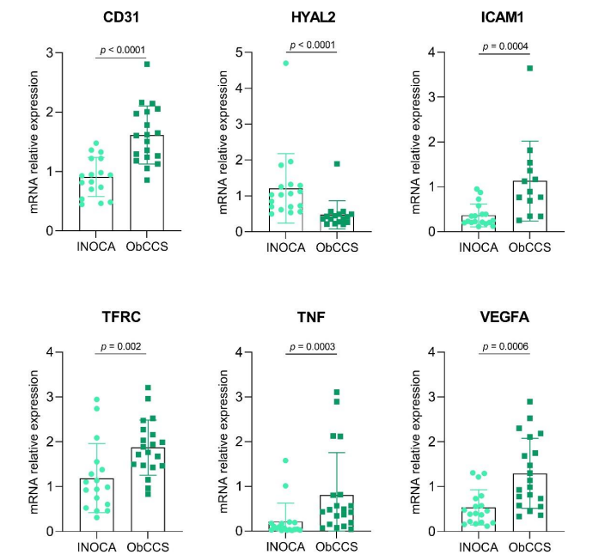
Figura 2. Gli istogrammi mostrano e confrontano i livelli di espressione genica delle molecole in esame nei due gruppi di pazienti (INOCA Vs ObCCS).
INOCA = ischemia in assenza di malattia coronarica ostruttiva
ObCCS = sindrome coronarica cronica ostruttiva
CD31 = Molecola di adesione delle piastrine e delle cellule endoteliali 1; HYAL2 = Ialuronidasi 2; ICAM1 = Molecola di Adesione Intercellulare 1; TFRC = recettore della transferrina; TNF = fattore di necrosi tumorale; VEGFA = fattore di crescita dell’endotelio vascolare A
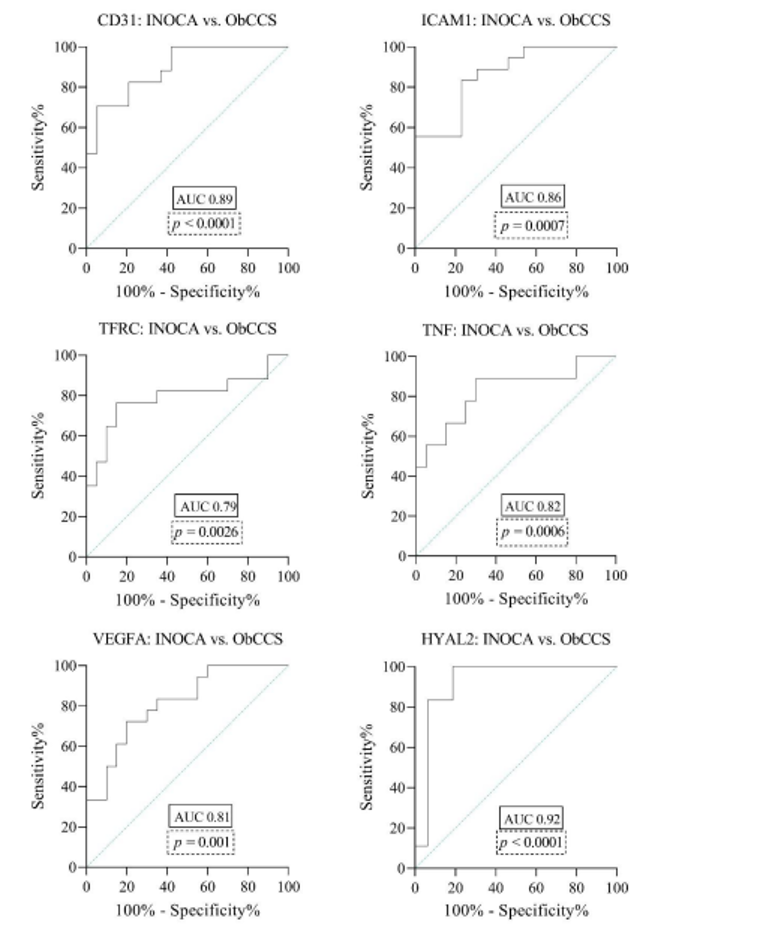
Figura 3. IMMAGINE CHIAVE
Curva ROC (Receiver Operating Characteristic) per la previsione di INOCA/ObCCS basata sull’espressione genica di CD31, ICAM1, TFRC, TNF, VEGFA, HYAL2.
L’area sotto la curva (AUC) è uguale a 0,5 quando la curva ROC corrisponde a casualità e 1,0 per una perfetta precisione. Un AUC maggiore di 0,9 ha un’accuratezza elevata, mentre 0,7–0,9 indica un’accuratezza moderata e 0,5–0,7 bassa precisione.
CD31 = Molecola di adesione delle piastrine e delle cellule endoteliali 1; HYAL2 = Ialuronidasi 2; ICAM1 = Molecola di Adesione Intercellulare 1; TFRC = recettore della transferrina; TNF = fattore di necrosi tumorale; VEGFA = fattore di crescita dell’endotelio vascolare A.
BIBLIOGRAFIA
- Bairey Merz, C.N.; Pepine, C.J.; Walsh, M.N.; Fleg, J.L. Ischemia and No Obstructive Coronary Artery Disease (INOCA): Developing Evidence-Based Therapies and Research Agenda for the Next Decade. Circulation 2017, 135, 1075–1092.
- Knuuti, J.; Wijns, W.; Saraste, A.; Capodanno, D.; Barbato, E.; Funck-Brentano, C.; Prescott, E.; Storey, R.F.; Deaton, C.; Cuisset, T.; et al. ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur. Heart J. 2020, 41, 407–477
- Murdaca, G.; Spanò, F.; Cagnati, P.; Puppo, F. Free radicals and endothelial dysfunction: Potential positive effects of TNF-inhibitors. Redox Rep. 2013, 18, 95–99.
- Goebel, S.; Huang, M.; Davis, W.C.; Jennings, M.; Siahaan, T.J.; Alexander, J.S.; Kevil, C.G. VEGF-A stimulation of leukocyte adhesion to colonic microvascular endothelium: Implications for inflammatory bowel disease. Am. J. Physiol. Gastrointest. Liver Physiol. 2006, 290, G648–G654.
- B.A.; Dunon, D. Leukocyte migration and adhesion. Adv. Immunol. 1995, 58, 345–416.
- Zehnder, J.L.; Shatsky, M.; Leung, L.L.; Butcher, E.C.; McGregor, J.L.; Levitt, L.J. Involvement of CD31 in lymphocyte-mediated immune responses: Importance of the membrane-proximal immunoglobulin domain and identification of an inhibiting CD31 peptide. Blood 1995, 85, 1282–1288.
- Eaton, J.W.; Qian, M. Molecular bases of cellular iron toxicity. Free Radic. Biol. Med. 2002, 32, 833–840.
- Mittal, M.; Siddiqui, M.R.; Tran, K.; Reddy, S.P.; Malik, A.B. Reactive oxygen species in inflammation and tissue injury. Antioxid. Redox Signal. 2014, 20, 1126–1167.
- Yang, H.; Zhu, L.; Chao, Y.; Gu, Y.; Kong, X.; Chen, M.; Ye, P.; Luo, J.; Chen, S. Hyaluronidase2 (Hyal2) modulates low shear stress-induced glycocalyx impairment via the LKB1/AMPK/NADPH oxidase-dependent pathway. J. Cell Physiol. 2018, 233, 9701–9715.
- Pedicino, D.; Vinci, R.; Giglio, A.F.; Pisano, E.; Porto, I.; Vergallo, R.; Russo, G.; Ruggio, A.; D’Aiello, A.; Flego, D.; et al. Alterations of Hyaluronan Metabolism in Acute Coronary Syndrome: Implications for Plaque Erosion. J. Am. Coll. Cardiol. 2018, 72,1490–1503.
- Naya, M.; Aikawa, T.; Manabe, O.; Obara, M.; Koyanagawa, K.; Katoh, C.; Tamaki, N. Elevated serum endothelin-1 is an independent predictor of coronary microvascular dysfunction in non-obstructive territories in patients with coronary artery disease. Heart Vessels 2021, 36, 917–923.
- Schroder, J.; Mygind, N.D.; Frestad, D.; Michelsen, M.; Suhrs, H.E.; Bove, K.B.; Gustafsson, I.; Kastrup, J.; Prescott, E. Proinflammatory biomarkers in women with non-obstructive angina pectoris and coronary microvascular dysfunction. Int. J. Cardiol. Heart Vasc. 2019, 24, 100370
- Hsieh, H.J.; Liu, C.A.; Huang, B.; Tseng, A.H.; Wang, D.L. Shear-induced endothelial mechanotransduction: The interplay betweenreactive oxygen species (ROS) and nitric oxide (NO) and the pathophysiological implications. J. Biomed. Sci. 2014, 21, 3.