Nicolò Sisti, Amato Santoro, Claudia Baiocchi, Simone Pistoresi, Antonio Biancofiore, Giulia Elena Mandoli, Matteo Cameli, Università di Siena
Abstract
Un uomo di 38 anni viene ricoverato dopo episodio sincopale secondario a tachicardia ventricolare monomorfa. Gli approfondimenti confermano la presenza di cardiopatia aritmogena del ventricolo destro. Viene eseguito uno studio elettrofisiologico con sistema di mappaggio, comprensivo di mappa di voltaggio endocardica unipolare e bipolare, che viene integrato con un’analisi speckle tracking del ventricolo destro a partire da immagini ottenute mediante ecocardiografia intracardiaca. Si evidenzia una riduzione dello strain ventricolare destro in corrispondenza delle aree che presentano potenziali frammentati. Tali risultati sottolineano che l’integrazione dello strain ventricolare destro ottenuto dall’ecocardiografia intracardiaca con la mappa di voltaggio potrebbe essere utilizzata per aumentare la sensibilità della diagnosi precoce della cardiomiopatia aritmogena del ventricolo destro.
Introduzione
La cardiomiopatia aritmogena del ventricolo destro (ARVC) rappresenta una delle principali cause di morte cardiaca improvvisa. Anomalie strutturali a carico del “triangolo della displasia” sono dimostrabili in una fase molto precoce di malattia [1,2] ed il substrato aritmico di tale condizione può essere documentato durante studio elettrofisiologico (SEF) e mappaggio elettroanatomico. Le alterazioni elettriche presentano interessanti correlazioni con le alterazioni meccaniche documentabili con analisi speckle tracking (STE) di ecocardiografia tradizionale ed intracardiaca (ICE).
Caso clinico
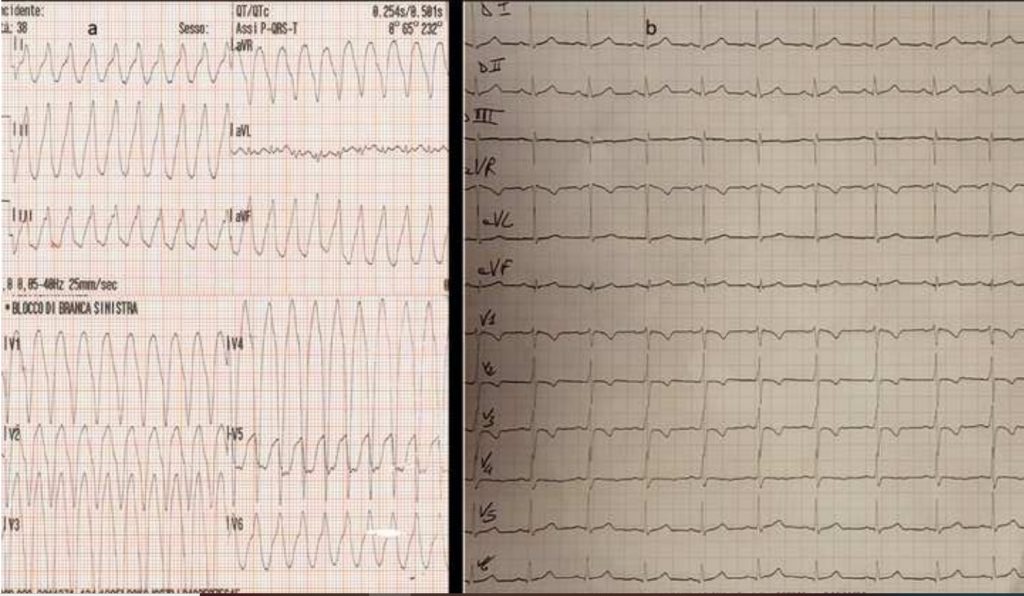
Un uomo di 38 anni veniva ricoverato dopo episodio sincopale e contestuale riscontro di tachicardia ventricolare (TV) con morfologia a blocco di branca sinistra (BBsn), asse inferiore . Al ripristino del ritmo sinusale veniva evidenziato a livello di V1 un aspetto compatibile con onda epsilon (Figura 1,a-b). L’ecocardiografia transtoracica (TTE) dimostrava un “bulging” a livello della parete libera del ventricolo destro (RV) mentre l’analisi speckle tracking (STE) rivelava una riduzione dello strain longitudinale (LS) in tutti e tre gli strati miocardici nella regione sotto-tricuspidalica. La risonanza magnetica cardiaca (CMR) confermava la discinesia dei segmenti medi della parete libera del ventricolo destro, inoltre mostrava delayed enhancement subepicardico a livello del setto anteriore medio-basale e della giunzione biventricolare inferiore. La coronarografia mostrava vasi indenni da stenosi. Al monitoraggio elettrocardiografico emergeva una doppia morfologia delle ectopie ventricolari: BBsn, asse inferiore e BBsn, asse superiore. In accordo con i criteri Task Force del 2010 [1,2] la diagnosi di ARVC avveniva sulla base dell’associazione di onda epsilon, T negative V1-V3 e tachicardie ventricolari non sostenute (TVNS) con BBsn, asse superiore (criterio maggiore), dimensioni del ventricolo destro lievemente aumentate e ridotta funzione ventricolare destra alla CMR (criterio minore).
SEF e mappaggio elettroanatomico
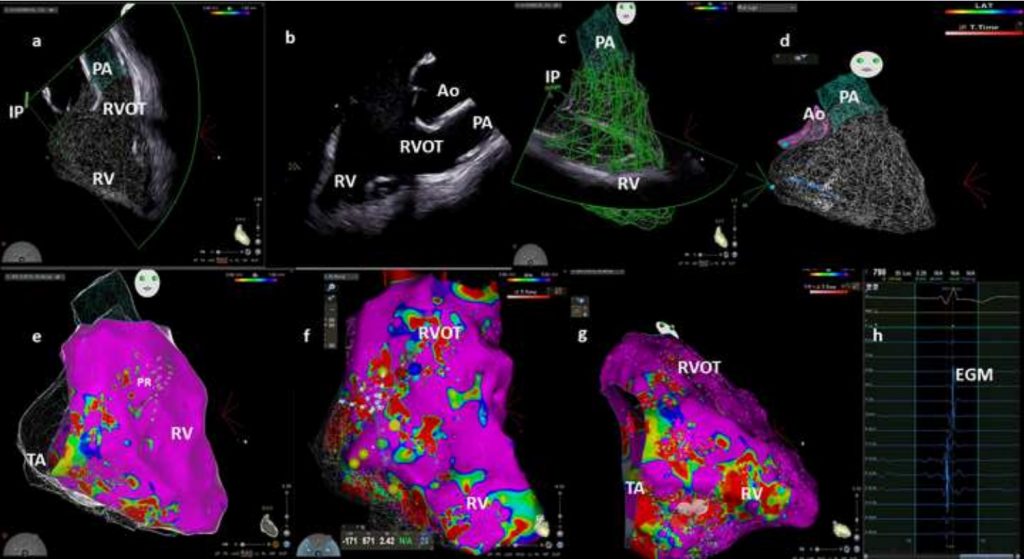
Il paziente è stato sottoposto a SEF con sistema di mappaggio. Durante ritmo sinusale sono state identificate due morfologie di battiti extrasistolici ventricolari originanti da parete inferiore e tratto di efflusso del RV (RVOT). Senza l’utilizzo di fluoroscopia e con l’utilizzo dell’ICE è stata eseguita una ricostruzione 3D del RV, che è stata poi integrata con la mappa di voltaggio (circa 6000 punti totali) (Figura 2,a-e). Le regioni endocardiche con ampiezza dei potenziali in mappaggio bipolare > 1,5 mV sono state definite normali, le aree con potenziali di ampiezza <0,5 mV sono state definite aree di fibrosi, le aree con potenziali in bipolare tra 0,5 e 1,5 mV o unipolare tra 3,5-5,5 mV come anormali (Figura 2-f). La mappa di voltaggio in unipolare e bipolare di RV ha mostrato aree di basso voltaggio associate a potenziali frammentati dal piano tricuspidalico fino all’apice (Figura 2, g-h). A livello di RVOT il mappaggio bipolare risultava normale mentre l’unipolare evidenziava aree di basso voltaggio a livello della zona antero-settale. Il pace mapping indicava una corrispondenza del 97% per la morfologia da parete inferiore e 95% per la morfologia da RVOT. La stimolazione ventricolare programmata (drive 600, 500, 400 con uno, due e tre extrastimoli da apice RV e RVOT fino a periodo refrattario) permetteva infine di indurre TVNS con le due morfologie già descritte.
Analisi dello strain miocardico
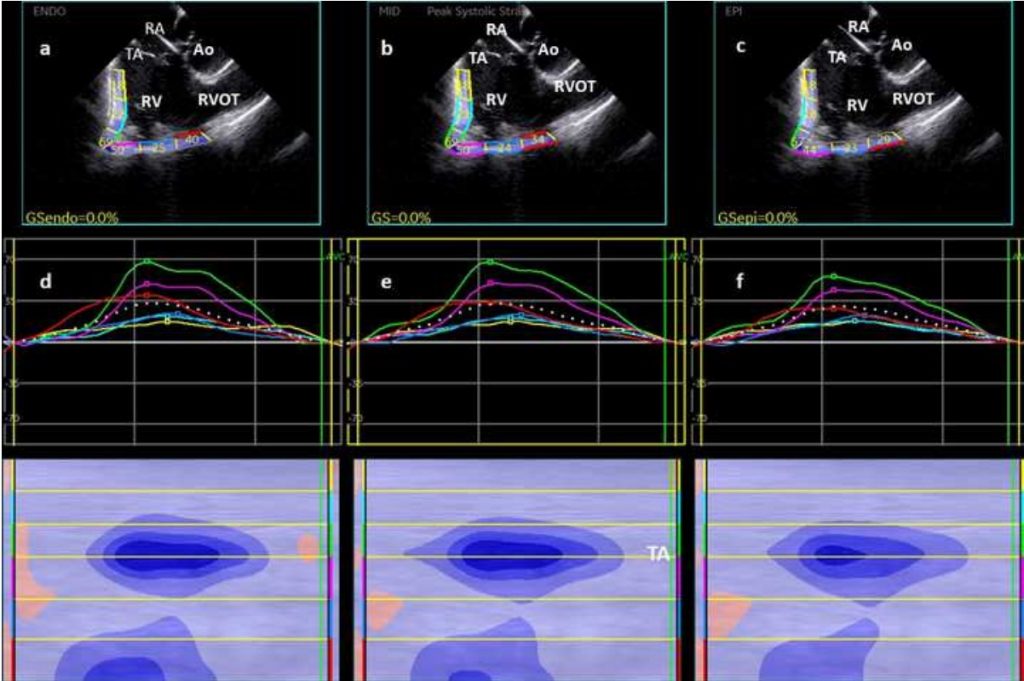
L’analisi STE dell’ecocardiogramma transtoracico mostrava riduzione dello strain longitudinale (LS) di RV dal piano tricuspidalico (segmenti basali) fino alla parete libera inferiore. L’analisi STE delle immagini ICE mostrava altresì riduzione del LS nei segmenti sotto-tricuspidalici in tutti e tre gli strati miocardici (Figura 3-a,b,c.) In particolare, il LS endocardico era ridotto dai segmenti subtricuspidalici fino all’apice in modo corrispondente con i potenziali frammentati raccolti durante mappa di voltaggio. A livello di RVOT anteriore, la mappa di voltaggio unipolare evidenziava potenziali frammentati mentre l’analisi STE rivelava una riduzione del LS epicardico.
Ablazione transcatetere e management successivo
In considerazione del substrato aritmico e della diagnosi di ARVC si procedeva ad ablazione transcatetere (TA) con controllo di potenza (30 W) per un totale di 2 minuti a livello di ciascun potenziale frammentato della parete inferiore, dove il mappaggio unipolare e bipolare aveva confermato ridotti voltaggi. Durante la procedura si assisteva a insorgenza di TV con morfologia analoga all’aritmia clinica. In terza giornata il paziente veniva sottoposto ad impianto di ICD sottocutaneo in prevenzione secondaria e veniva dimesso in terapia betabloccante. A distanza di 6 mesi non venivano documentati episodi aritmici ventricolari
Discussione
Didascalie figure
Figura 1a: ECG registrato sul territorio indicativo di tachicardia ventricolare con morfologia tipo blocco di branca sinistro e asse inferiore
Figura 1b: ECG registrato poche ore dopo che evidenzia onda epsilon in V1 e inversione onde T in V1-V3
Figura 2. a: 3D “home view” dell’ecocardiogramma intracardiaco in cui la sonda è posizionata nell’atrio destro. b: 2D “home view” del tratto di afflusso ed efflusso del ventricolo destro c: Visualizzazione 2D con eco intracardiaco della sezione trasversale del ventricolo destro. I segmenti in verde sono quelli acquisiti per la ricostruzione ecocardiografica 3D del ventricolo destro. d: Mappa 3D del ventricolo destro con eco intracardiaco. Il catetere mappante multipolare è nell’afflusso del ventricolo destro. e: Rappresentazione di una fusione tra mappa con eco intracardiaco e mappa di voltaggio bipolare. Aree di basso voltaggio sono state identificate in sede sotto-tricuspidalica e apice inferiore del ventricolo destro. f: Rappresentazione di una fusione tra mappa con eco intracardiaco e mappa di voltaggio unipolare. Aree di basso voltaggio sono identificate nel tratto di efflusso antero-settale. g: Mappa di fusione tra eco intracardiaco e voltaggio bipolare durante ablazione transcatetere dei potenziali frammentati h: Bassi potenziali registrati.
Figura 3. Analisi speckle tracking strato-specifica del ventricolo destro applicata alle immagini ottenute con eco intracardiaco. Da sinistra: strain longitudinale endocardico, strain longitudinale mesocardico, strain longitudinale epicardico.
Bibliografia
1. Corrado D, van Tintelen PJ, McKenna WJ et al. Arrhythmogenic right ventricular cardiomyopathy: evaluation of the current diagnostic criteria and differential diagnosis. Eur Heart J. 2020;41:1414- 1429.
2. Marcus FI, McKenna WJ, Sherrill D, Basso C, Bauce B, Bluemke DA, Calkins H, Corrado D, Cox MG, Daubert JP, Fontaine G, Gear K, Hauer R, Nava A, Picard MH, Protonotarios N, Saffitz JE, Sanborn DM, Steinberg JS, Tandri H, Thiene G, Towbin JA, Tsatsopoulou A, Wichter T, Zareba W. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia: proposed modification of the Task Force Criteria. Eur Heart J. 2010;31:806-14.
3. Enriquez A, Saenz LC, Rosso R, Silvestry FE, Callans D, Marchlinski FE, Garcia F. Use of Intracardiac Echocardiography in Interventional Cardiology: Working With the Anatomy Rather Than Fighting It. Circulation. 2018;137:2278-2294.
4. Mast TP, Taha K, Cramer MJ, Lumens J, van der Heijden JF, Bouma BJ, van den Berg MP, Asselbergs FW, Doevendans PA, Teske AJ. The Prognostic Value of Right Ventricular Deformation Imaging in Early Arrhythmogenic Right Ventricular Cardiomyopathy. JACC Cardiovasc Imaging. 2019;12:446- 455.
5. Malik N, Win S, James CA, Kutty S, Mukherjee M, Gilotra NA, Tichnell C, Murray B, Agafonova J, Tandri H, Calkins H, Hays AG. Right Ventricular Strain Predicts Structural Disease Progression in Patients With Arrhythmogenic Right Ventricular Cardiomyopathy. J Am Heart Assoc. 2020;9:e015016.
6. Bandera F, Baghdasaryan L, Mandoli GE, Cameli M. Multimodality imaging predictors of sudden cardiac death. Heart Fail Rev. 2020;25:427-446.
7. Sarvari SI, Haugaa KH, Anfinsen OG, Leren TP, Smiseth OA, Kongsgaard E, Amlie JP, Edvardsen T. Right ventricular mechanical dispersion is related to malignant arrhythmias: a study of patients with arrhythmogenic right ventricular cardiomyopathy and subclinical right ventricular dysfunction. Eur Heart J. 2011;32:1089-96. 8. Chen S, Ren JF, Jiang C, Marchlinski FE. Intracardiac Echocardiography-Derived Right Ventricular Myocardial Strain Deformation Patterns with Segmental Dyssynchrony in Arrhythmogenic Cardiomyopathy. J Am Soc Echocardiogr. 2021;34:100-102.
