Roberta Lotti MDa,b, Vered Gilad MDa, Eugenio Sessarego MDa,b, Giuseppe Mascia MD, PhDa, Francesca Cavalla MDc , Giuseppe Pomè MD, PhDd, Francesco Santoro MDd, Gianluca Trocchio MDd , Roberta Della Bona MD, PhDa, Italo Porto, MD, PhDa,b
a. DICATOV – Cardiothoracic and Vascular department, San Martino Hospital, IRCCS for Oncology and Neurosciences, Genoa, Italy
b. Department of Internal Medicine and Medical Specialties (DIMI) Clinic of Cardiovascular Diseases, University of Genoa, Genoa Italy
c. Cardiothoracic department, Istituto Clinico di Alta Specialità (ICLAS), Rapallo, Italy
d. Pediatric Cardiothoracic and Vascular department, IRRCS Giannina Gaslini Institute, Genoa, Italy
Abstract
Descriviamo il raro caso di un paziente affetto da Tetralogia di Fallot con atresia polmonare sottoposto a correzione chirurgica in età tardo-adulta (63 anni) a seguito di multipli interventi palliativi in età sia pediatrica sia adulta. A distanza di un anno dall’intervento di correzione, il paziente veniva ricoverato presso il nostro Dipartimento di Cardiologia per tachicardia ventricolare sostenuta. Discuteremo quindi le attuali evidenze sulle tecniche palliative, gli effetti cardiovascolari a lungo termine della cianosi cronica, la possibilità di correzione chirurgica in età adulta e le possibili complicanze aritmiche.
Caso clinico:
Un uomo di 64 anni accedeva presso il nostro ospedale per dispnea ingravescente e cardiopalmo. Dal punto di vista anamnestico, al paziente era stata diagnosticata in infanzia la Tetralogia di Fallot con atresia polmonare e scarso sviluppo del circolo polmonare, trattata con tre successivi interventi palliativi: Blalock-Taussing (BT) shunt classico all’età di 3 anni, BT shunt modificato sull’arteria polmonare destra all’età di 14 anni ed uno shunt centrale (protesi tubulare di Dacron tra la biforcazione polmonare e l’aorta ascendente) all’età di 54 anni. La valutazione pre-operatoria in occasione dell’apposizione dello shunt centrale includeva la risonanza magnetica cardiaca (CMR) e l’angio-TC, con evidenza di ipoplasia delle arterie polmonari, occlusione dei precedenti BT shunt e presenza di numerosi collaterali sistemico-polmonari. In conseguenza alla cianosi cronica, il paziente veniva inoltre sottoposto a cicli di salassi ed aveva riportato anche un TIA dopo alcuni anni dall’ultimo shunt.
All’età di 63 anni veniva sottoposto a nuova valutazione clinica a causa di un progressivo deterioramento del performance status con comparsa di intolleranza allo sforzo ingravescente. Al cateterismo si osservava occlusione dello shunt centrale e dimensioni ottimali delle arterie polmonari, in assenza di coronaropatia ostruttiva. Considerando i sintomi e l’anatomia polmonare riscontrata, si decideva dunque di procedere ad intervento chirurgico correttivo mediante interposizione di un dotto valvolato tra il ventricolo destro e la biforcazione polmonare, chiusura del setto interventricolare mediante patch e dissoluzione dello shunt centrale. Il decorso postoperatorio risultava scevro di complicanze e nei successivi mesi il paziente riportava assenza di sintomi e significativo miglioramento della tolleranza allo sforzo. All’ecocardiogramma di dimissione si osservava corretto posizionamento e funzione del dotto, moderata disfunzione biventricolare (FEVD 40% e FEVS 45%), ectasia del bulbo aortico e lieve insufficienza valvolare aortica.
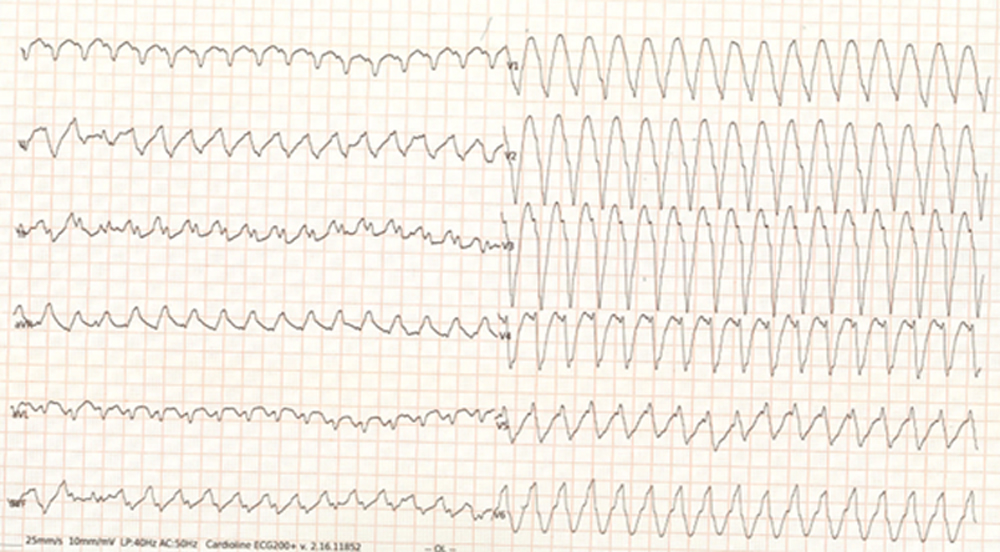
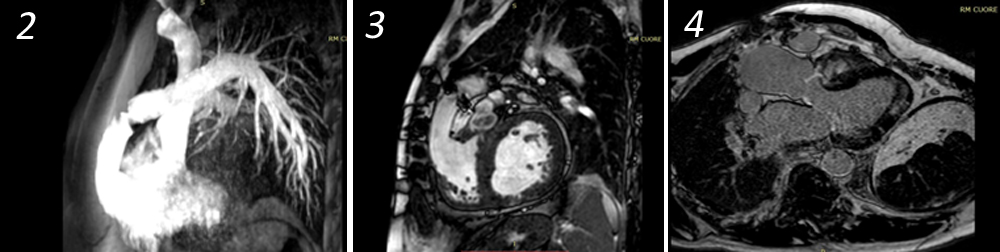
A distanza di un anno dall’intervento di correzione, tuttavia, il paziente accedeva presso il nostro Dipartimento per dispnea ingravescente e cardiopalmo. All’esame obiettivo non si evidenziava nulla di patologico eccetto toni cardiaci tachicardici, ritmici. La pressione arteriosa sistemica era 130/80 mmHg e la saturazione di ossigeno 95%. Veniva dunque effettuato un ECG a 12 derivazioni che dimostrava una tachicardia ventricolare sostenuta (TVS) a 160 bpm, con morfologia a blocco di branca sinistra (BBS) ed asse inferiore (Figura 1). Escluse eventuali disionie, in seguito alla comparsa di instabilità emodinamica si procedeva a sedazione e cardioversione elettrica a 150 Joule con ripristino del ritmo sinusale, in assenza di significative alterazioni della ripolarizzazione ventricolare. Veniva avviata quindi una terapia beta-bloccante a bassa dose, si effettuava una rivalutazione ecocardiografica, che per quanto apparentemente sovrapponibile alla precedente risultava poco informativa a causa della pessima qualità di finestra acustica, e si procedeva infine all’esecuzione di CMR. Quest’ultima dimostrava una discinesia del segmento infero-apicale, conservata funzione biventricolare e late gadolinium enhancement (LGE) multifocale, in particolare a carico del setto interventricolare, della porzione inferoapicale del ventricolo sinistro e del tratto di efflusso del ventricolo destro alla giunzione con il dotto valvolato (Figure 2,3,4).
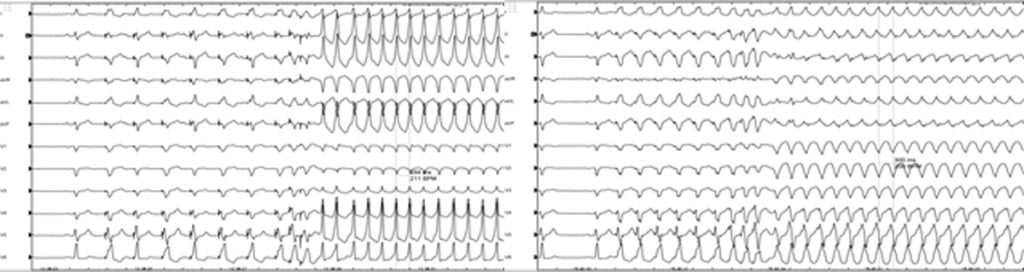
Successivamente, il paziente veniva sottoposto a studio elettrofisiologico, che documentava l’assenza di aritmie atriali inducibili, mentre venivano indotte tachicardie ventricolari (TV) a quattro morfologie differenti (Figure 5 e 6). Pertanto, considerando l’episodio di TVS sintomatica, l’induzione di quattro differenti morfologie di TV allo studio elettrofisiologico ed il pattern di LGE multifocale alla CMR, si decideva di soprassedere a tentativi di ablazione transcatetere e si procedeva ad impianto di ICD endocavitario. Al follow-up, il paziente si manteneva asintomatico e con buona tolleranza allo sforzo e, allo studio elettrofisiologico di controllo, veniva indotta una fibrillazione ventricolare (FV), prontamente riconosciuta e trattata dall’ICD.
Discussione:
La riparazione chirurgica rappresenta il trattamento ottimale per i pazienti affetti da Tetralogia di Fallot, tuttavia non sempre risulta anatomicamente fattibile. Tra i meccanismi di compenso alla cianosi cronica riscontriamo l’eritrocitosi, la deviazione a destra della curva di dissociazione dell’ossiemoglobina ed un aumento della portata cardiaca (1), mentre sono complicanze comuni le anomalie ematologiche e coagulative, l’acidosi metabolica, le aumentate resistenze vascolari polmonari e l’ischemia subendocardica responsabile della fibrosi e della disfunzione miocardica (2,3).
Numerose tecniche palliative di shunt sistemico polmonare sono state sviluppate per aumentare il flusso vascolare polmonare, per ridurre la cianosi e per stimolare la crescita arteriosa polmonare. L’utilizzo di BT shunt, classico e modificato, comporta un basso rischio chirurgico, ma si associa ad un minor sviluppo delle arterie polmonari e a frequenti distorsioni delle stesse (4), mentre gli shunt centrali mostrano una più elevata probabilità di crescita delle arterie polmonari, a prezzo tuttavia di un maggior rischio di ipertensione polmonare (5).
Se sussistono le condizioni anatomiche appropriate (due ventricoli indipendenti e sufficiente circolo polmonare), la riparazione chirurgica è effettuabile con successo anche in età avanzata. Nella popolazione adulta, la mortalità postoperatoria varia dall’1,3% al 16%, ed è maggiormente influenzata dall’età del paziente, dalla cianosi prolungata, dalla disfunzione ventricolare sinistra e/o destra, dall’esperienza dell’operatore e del centro (6-11).
Le aritmie ventricolari sono complicanza frequente negli adulti con Tetralogia di Fallot e la morte cardiaca improvvisa è riportata in 1-3.5% dei casi. Le TV sono classificate in due categorie principali: polimorfe e monomorfe (12,13,14). Le TV polimorfe sono associate a diffusa fibrosi miocardica e disfunzione, spesso in conseguenza alla cianosi prolungata. Le TV monomorfe sono tipicamente conseguenza di cicatrici chirurgiche e sono anatomicamente definite “istmi” (14,15). L’ablazione transcatetere è fattibile in presenza di substrati anatomici e può migliorare la qualità di vita, benché sia generalmente raccomandata in aggiunta all’impianto di ICD dato l’elevato rischio di ricorrenza (16,17). L’impianto di ICD in prevenzione secondaria è raccomandato in tutti i pazienti, mentre l’impianto di ICD in prevenzione primaria dovrebbe essere considerato in pazienti portatori di più fattori di rischio per morte cardiaca improvvisa, considerando anche la disponibilità di nuovi dispositivi (ad esempio, l’ICD sottocutaneo) che comportano meno complicanze a lungo termine (17,18).
Bibliografia:
- Oechslin E. Hematological management of the cyanotic adult with congenital heart disease. Int J Cardiol 2004;97 (1):109-115.
- Pridjian AK, Bove EL, Lupinetti FM. The effects of cyanosis on myocardial blood flow, oxygen utilization, and lactate production in dogs. J Thorac Cardiovasc Surg.1995;109(5):849-53.
- Rocchini A, Rosenthal A, Freed M, Castaneda AR, Nadas AS. Chronic Congestive Heart Failure after Repair of Tetralogy of Fallot. Circulation. 1977;56(2):305-310.
- Gladman G, McCrindle BW, Williams WG, Freedom RM, Benson LN. The modified Blalock-Taussig shunt: clinical impact and morbidity in Fallot’s tetralogy in the current era. J Thorac Cardiovasc Surg. 1997;114(1):25-30.
- Azzolina G, Russo PA, Maffei G, Marchese A. Waterson Anastomosis in Two-Stage Correction of Severe Tetralogy of Fallot: Ten Years of Experience. Ann Thorac Surgery. 1982;34(4):413-21.
- Park I S, Leachman RD, Cooley DA. Total Correction of Tetralogy of Fallot in Adults: Surgical Results and Long-term Follow-up. Tex Heart Inst J. 1987; 14(2):160-169.
- Atik FA, Atik E, da Cunha CR, Caneo FL, Assad RS, Jatene MB et al. Long-term results of correction of tetralogy of Fallot in adulthood. Eur J Cardiothorac Surg. 2004;25(2):250-5.
- Hu DC, Seward JB, Puga FJ, Fuster V, Tajik AJ.Total Correction of Tetralogy of Fallot at Age 40 Years and Older: Long-Term Follow-Up. J Am Coll Cardiol.1985;5(1):40-4.
- Presbitero P, Demarie D, Aruta E, Villani M, Disumma M, Ottino GM et al. Results of Total Correction of Tetraology of Fallot Performed in Adults. Ann Thorac Surg.1988;46(3):297-301.
- Attenhofer Jost CH, Connolly HM, Burkhart HM, Scott CG, Dearani JA, Carroll AJ et al. Tetralogy of Fallot Repair in Patients 40 Years or Older. Mayo Clin Proc. 2010; 85(12): 1090–1094.
- Ghavidel AA, Javadpour H, Tabatabei MB, Adambeig A, Raeisi K, Noohi K. Complete Surgical Repair of Tetralogy of Fallot in Adults, Is it Ever Too Late? J Card Surg. 2008;23(1):23-6.
- Maury P, Sacher F, Rollin A, Mondoly P, Duparc A, Zeppenfeld K et al. Ventricular arrhythmias and sudden death in tetralogy of Fallot. Arch Cardiovasc Dis. 2017;110(5):354-362.
- Hernández-Madrid A, Paul T, Abrams D, Aziz PF, Blom NA, Chen J et al. Arrhythmias in congenital heart disease: A position paper of the European Heart Rhythm Association (EHRA), Association for European Paediatric and Congenital Cardiology (AEPC), and the European Society of Cardiology (ESC) Working Group on Grown-up Congenital heart disease, endorsed by HRS, PACES, APHRS, and SOLAECE. Europace.2018;20(11):1719-1753.
- Khairy P, Aboulhosn J, Gurvitz MZ, Opotowsky AR, Mongeon FP, Kay J, et al. Alliance for Adult Research in Congenital Cardiology (AARCC). Arrhythmia burden in adults with surgically repaired tetralogy of Fallot: a multi-institutional study. Circulation. 2010;122(9):868-75.
- Kapel GF, Sacher F, Dekkers OM, Watanabe M, Blom NA, Thambo JB, et al. Arrhythmogenic anatomical isthmuses identified by electroanatomical mapping are the substrate for ventricular tachycardia in repaired Tetralogy of Fallot. Eur Heart J. 2017;38(4):268-276.
- Valdigem BP, Moreira DAR, Andalaft RB, Santana MVT, Sierra-Reyes CA, Mizzacci C. Successful treatment of ventricular arrhythmia in tetralogy of fallot repair using catheter ablation. Brazilian J Cardiovasc Surg. 2018;33(4):418–423.
- Baumgartner H, De Backer J. The ESC Clinical Practice Guidelines for the Management of Adult Congenital Heart Disease 2020. Eur Heart J. 2020;41(43):4153-4154.
- Willy K, Reinke F, Bögeholz N, Köbe J, Eckardt L, Frommeyer G. The entirely subcutaneous ICDTM system in patients with congenital heart disease: experience from a large single-centre analysis. EP Europace. 2019; 21(10):1537-1542.
