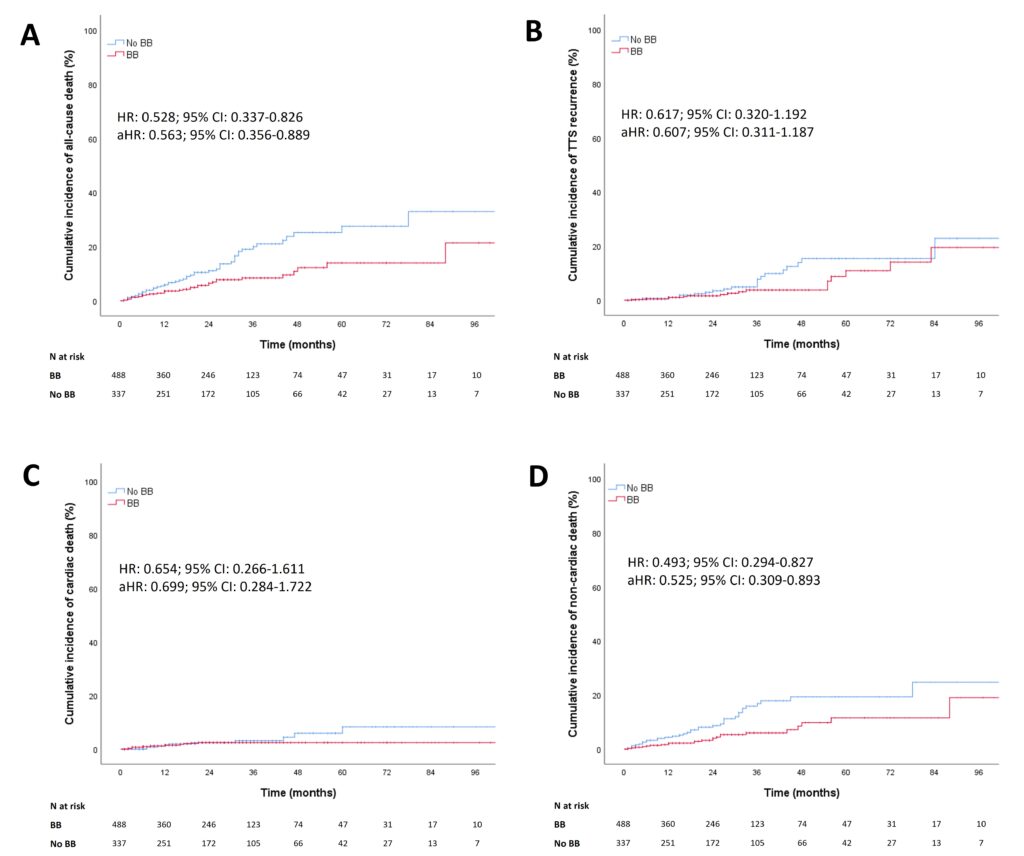
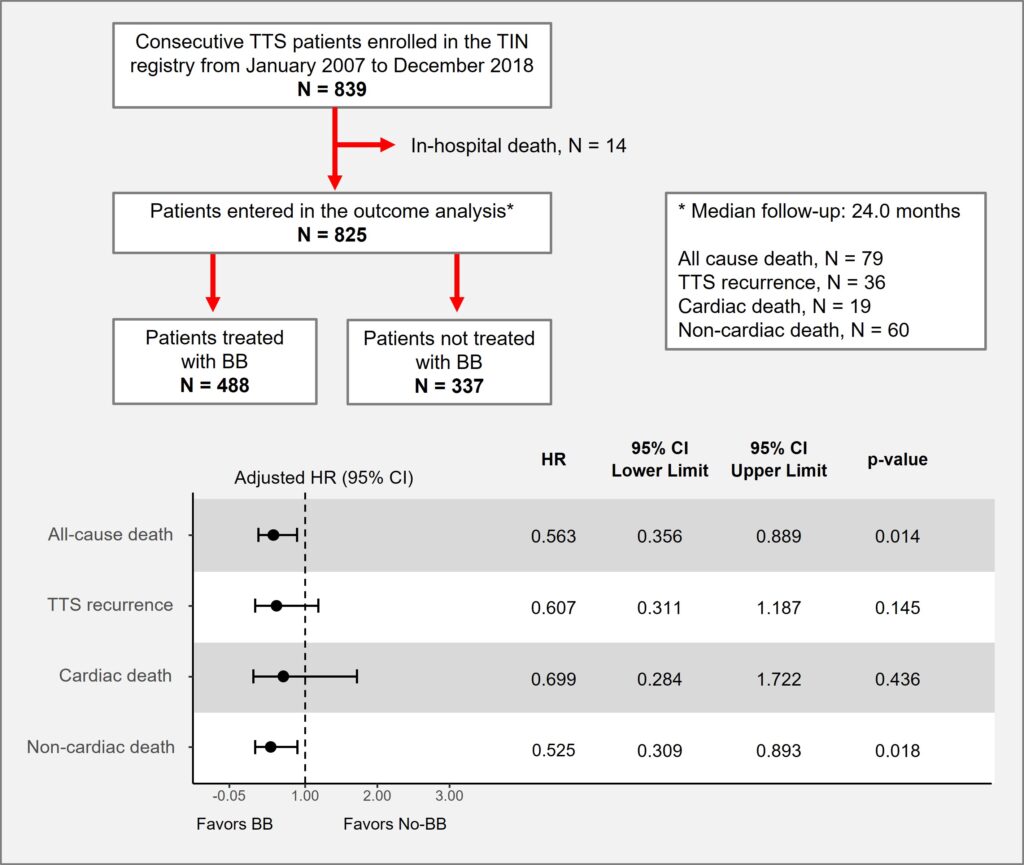
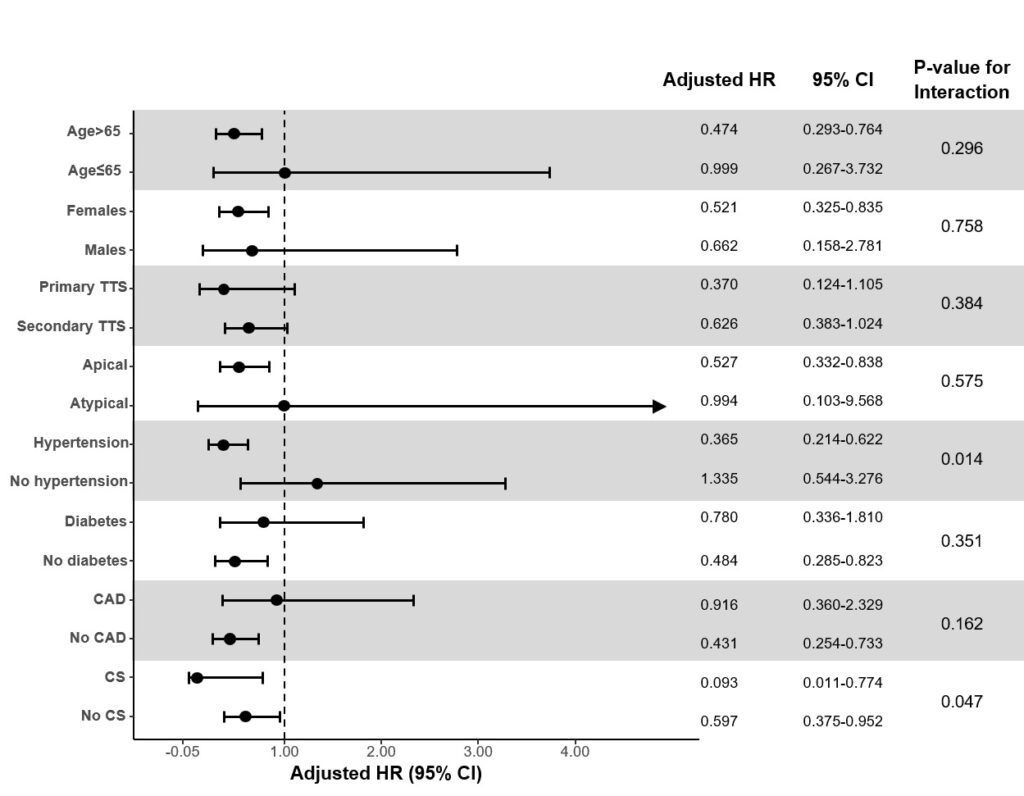
Daniele De Feo1, Anna D’Anzi1, Vincenzo Pestrichella2, Pietro Scicchitano3, Marco Matteo Ciccone1, Sabino Iliceto2, Carlo Lafranceschina2, Vito Caragnano2
1 Division of University Cardiology, Cardiothoracic Department, Policlinico University Hospital, 70124 Bari, Italy;
2 Interventional Cardiology Service, “Mater Dei” Hospital, 70125 Bari, Italy;
3 Division of Cardiology, “F. Perinei” Hospital, 70022 Altamura, Italy;
ABSTRACT
Il deficit di sfingomielinasi acida, noto anche come malattia di Niemann-Pick (NP), è una rara patologia autosomica recessiva causata dalla carenza dell’enzima lisosomiale sfingomielinasi acida con conseguente accumulo di sfingomielina nelle cellule reticolo-endoteliali e progressiva disfunzione multiorgano.
In letteratura sono descritti solo pochi casi di valvulopatie associate a tale malattia e, in questo scenario clinico, esse vengono trattate esclusivamente mediante correzione chirurgica.
Riportiamo il primo caso di un paziente con malattia di NP tipo B e situs inversus totalis affetto da stenosi aortica severa sintomatica sottoposta a trattamento mediante impianto transcatetere di protesi valvolare aortica (TAVI).
CASO CLINICO
Descriviamo il caso di un paziente di 65 anni affetto da malattia di NP tipo B (diagnosticata all’età di 20 anni), situs inversus totalis, stenosi valvolare aortica severa sintomatica e numerose comorbidità quali BPCO enfisematosa, bronchiectasie, tiroidite di Hashimoto, osteoporosi femorale severa (precedentemente corretta con artroprotesi di ginocchio), osteopenia lombare con conseguente limitazione funzionale e sindrome ansioso-depressiva.
La malattia di NP è una rara patologia genetica autosomica recessiva causata della mutazione bi-allelica del gene SMPD1 e conseguente deficit dell’enzima lisosomiale sfingomielinasi acida che catalizza l’idrolisi della sfingomielina in ceramide e fosfocolina permettendone lo smaltimento. Il tipo A possiede < 5% della normale attività sfingomielinasica, con conseguente epatosplenomegalia, difficoltà di accrescimento, neurodegenerazione rapidamente progressiva e decesso entro 2 o 3 anni di età. I pazienti con il tipo B (attività enzimatica entro il 5-10% del normale) possiedono invece un fenotipo più variabile, con frequenti epatosplenomegalia, linfoadenopatia, pancitopenia e lieve interessamento neurologico.1, 2 Per la diagnosi di malattia il paziente è stato sottoposto in giovane età a biopsia di midollo osseo che ha evidenziato ipercellularità e abbondanti cellule schiumose istiocitiche come da malattia da accumulo, test genetici con riscontro della mutazione omozigote c.1799 G >A dell’esone 6 del gene SMPD1 (che determina la sostituzione dell’istidina con l’arginina) e test enzimatici che hanno dimostrato la ridotta attività dell’enzima sfingomielinasi. Venivano altresì escluse altre patologie da accumulo (malattia di Fabry, glicogenosi tipo 2 e mucopolisaccaridosi tipo1).
È opportuno sottolineare che la malattia di NP si associa frequentemente a malattie cardiovascolari, sia in età infantile che in età adulta, rendendo necessario uno stretto follow-up cardiologico. Una valutazione sistematica della morbilità e della mortalità in 103 pazienti con NP tipo B ha mostrato che il 9% dei pazienti presenta infatti malattia coronarica o valvolare.3 Sebbene la causa delle valvulopatie frequentemente associate a NP non sia stata ancora identificata con certezza, la malattia coronarica è invece presumibilmente correlata al profilo lipidico pro aterogeno (dislipidemia mista) secondario al deficit enzimatico.1, 3, 4 La disfunzione ventricolare, spesso letale in questi pazienti, può essere dovuta al progressivo deterioramento della funzionalità polmonare o secondaria a sindrome coronarica.5
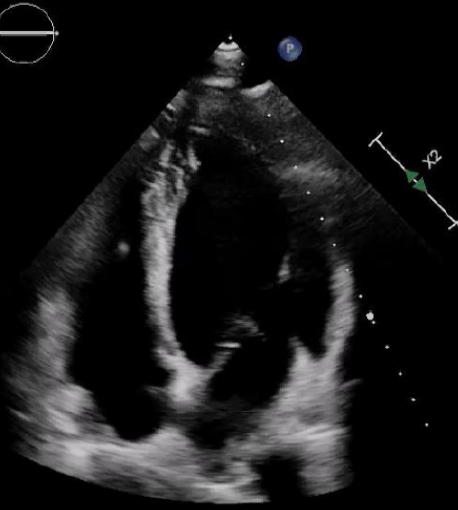
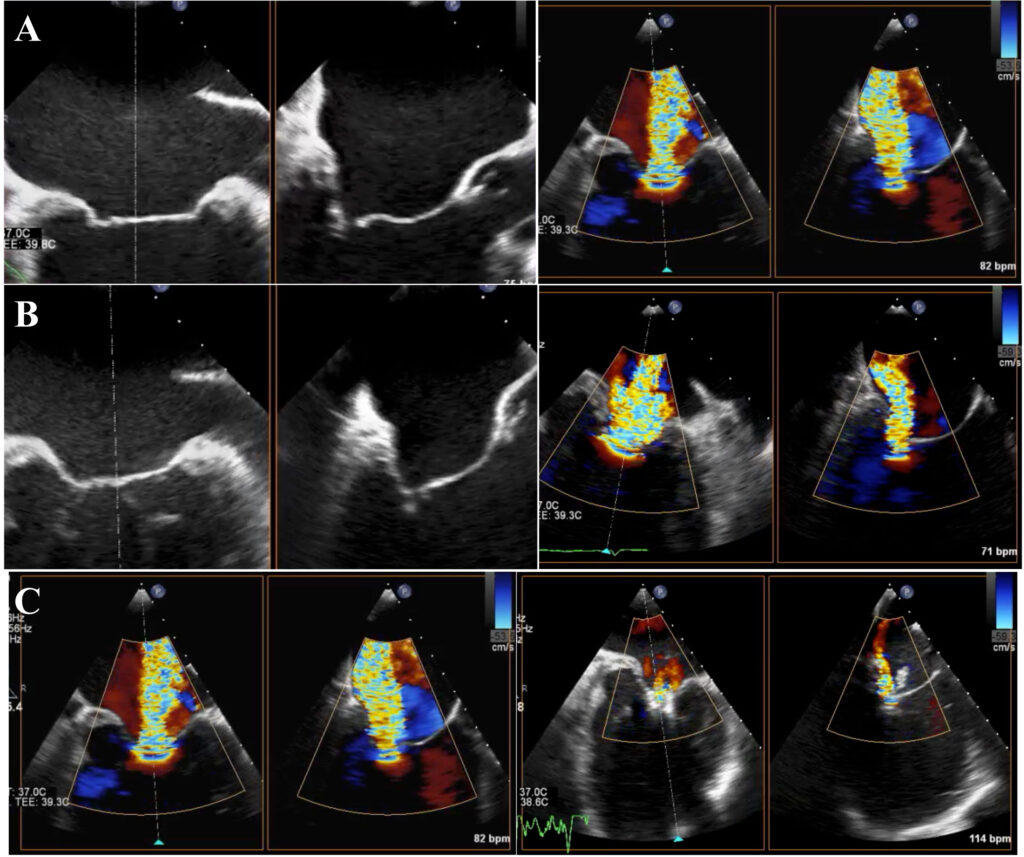
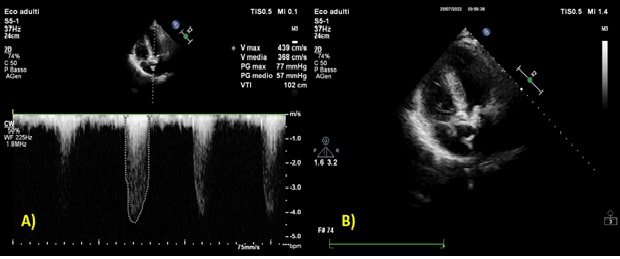
A seguito dell’insorgenza di dispnea per sforzi lievi moderati e vertigini nel corso dei mesi precedenti, il paziente ha eseguito valutazione cardiologica con riscontro ecocardiografico di riduzione della frazione di eiezione (FE) (45%) rispetto ai precedenti controlli (FE 56%, 12 mesi prima), dissinergia settale di nuovo riscontro e peggioramento della stenosi valvolare aortica già nota con un gradiente medio di 56 mmHg (precedentemente 36 mmHg) (figura 1) ed area valvolare di 0.8 cm2, associato ad insufficienza aortica di grado lieve ed ectasia di radice aortica (40 mm) e aorta ascendente (42 mm).
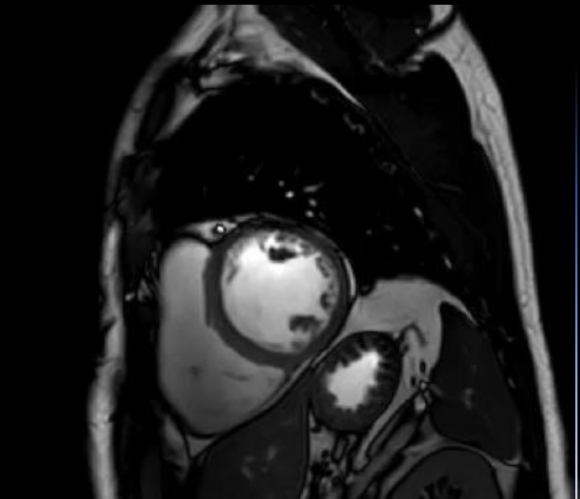
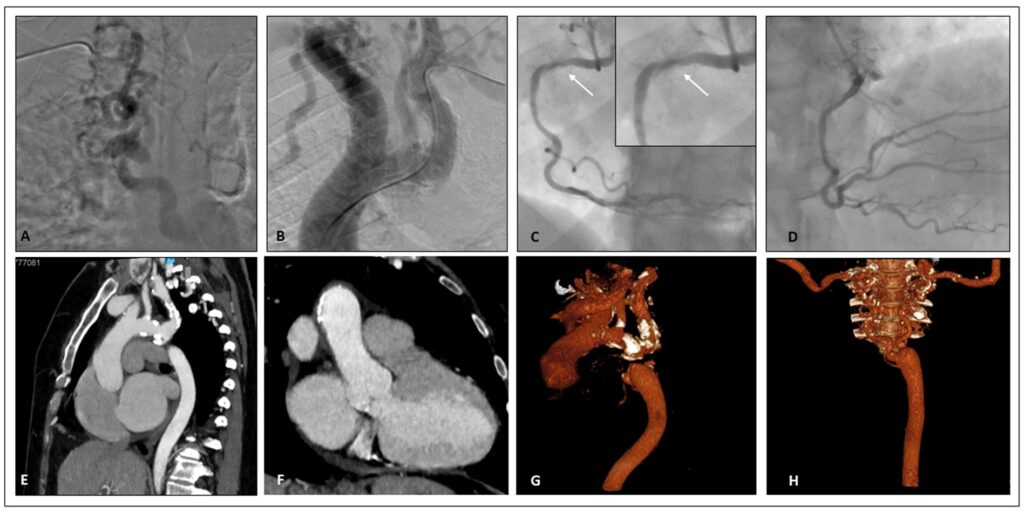
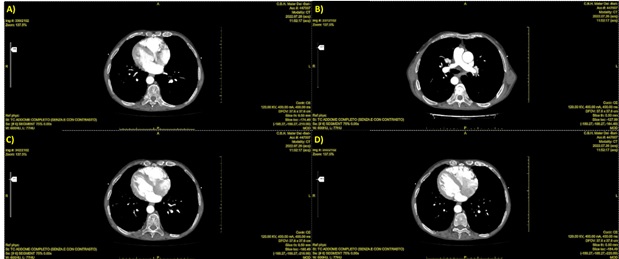
La TC total-body e l’angio TC (figura 2), eseguite in previsione della correzione valvolare, confermavano il situs inversus totalis ed evidenziavano accessi vascolari femorali idonei alla procedura transcatetere.
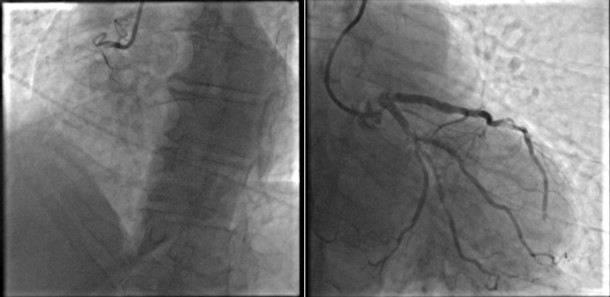
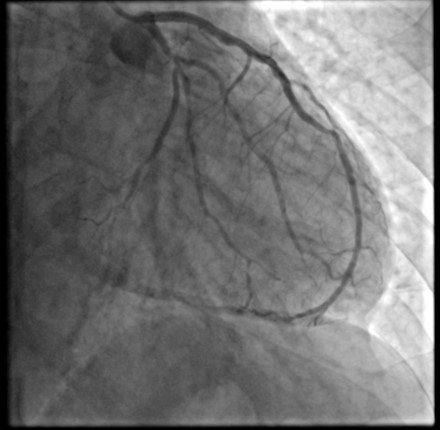
La coronarografia documentava origine inversa degli osti coronarici (tronco comune ad emergenza dal seno coronarico destro e coronaria destra, dominante, ad origine dal seno sinistro), con lieve ateromasia in assenza di stenosi angiograficamente significative.
Dopo valutazione collegiale in Heart Team, tenendo conto della complessa situazione sistemica e dell’elevato rischio chirurgico del paziente (Euroscore II > 6%), si optava per una correzione valvolare mediante TAVI, sebbene in letteratura non fosse descritta alcuna esperienza precedente di correzione percutanea della valvulopatia aortica in pazienti con malattia di NP.
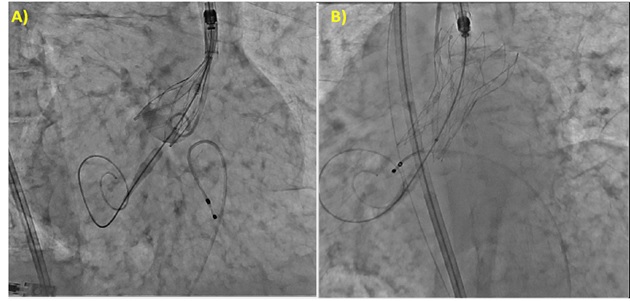
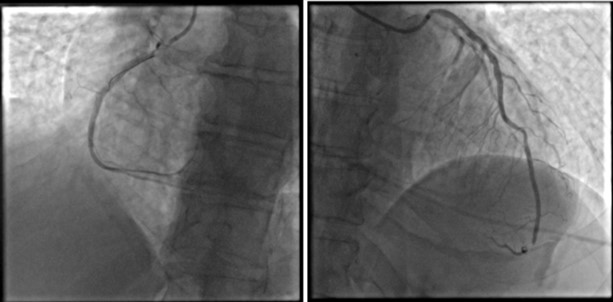
La procedura è stata condotta previo posizionamento di pacemaker temporaneo attraverso vena femorale sinistra (rimosso al termine della procedura), pre-dilatazione della valvola mediante pallone Edwards 20×40 mm ed impianto di protesi biologica transcatetere Portico 29 mm. Per evidenza di leak periprotesico di grado moderato si è proceduto a post-dilatazione della valvola con pallone Edwards 23×40 mm con riduzione del leak al successivo controllo angiografico (Figura 3).
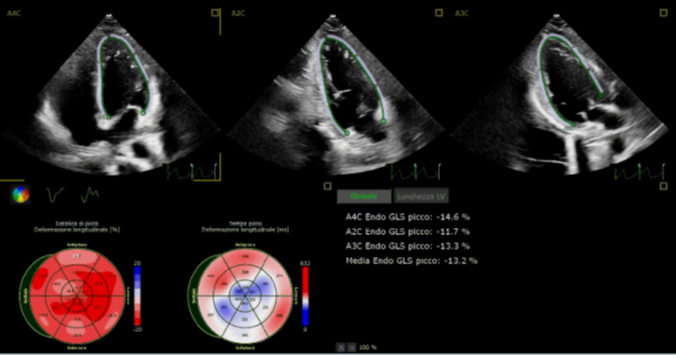
L’ecocardiogramma post-impianto confermava il corretto posizionamento della bioprotesi e l’assenza di gradiente trans-protesico (gradiente medio: 5 mmHg), con leak peri-protesico di grado lieve-moderato. Al controllo ecocardiografico di follow-up a 6 mesi non veniva evidenziato un aumento del gradiente medio (6 mmHg) e si riscontrava ulteriore riduzione del leak peri-protesico.
DISCUSSIONE
Sebbene in letteratura vi siano pochi dati circa la correzione chirurgica della stenosi aortica in pazienti con malattia di NP, spesso con outcome sfavorevoli,6 non esistono invece ancora evidenze sull’utilizzo della TAVI in tale setting clinico. Il presente case report descrive l’unico caso finora noto in letteratura di un paziente con malattia di NP, situs inversus totalis e stenosi valvolare aortica severa sottoposto a TAVI. Sebbene siano necessari ulteriori conferme, soprattutto sugli outcome a lungo termine, reputiamo che la TAVI possa essere una valida opzione per il trattamento della stenosi aortica in relazione alle complesse caratteristiche cliniche di questi pazienti. Alla luce di ciò, la realizzazione di un registro dei pazienti affetti da malattia di NP e concomitanti patologie cardiovascolari potrebbe essere di indubbio vantaggio nella gestione clinica e nel follow-up di tale condizione.
BIBLIOGRAFIA
1. Schuchman, E.H. and R.J. Desnick, Types A and B Niemann-Pick disease. Mol Genet Metab, 2017. 120(1-2): p. 27-33.
2. Wasserstein, M.P., R.J. Desnick, E.H. Schuchman, et al., The natural history of type B Niemann-Pick disease: results from a 10-year longitudinal study. Pediatrics, 2004. 114(6): p. e672-7.
3. McGovern, M.M., N. Lippa, E. Bagiella, E.H. Schuchman, R.J. Desnick, and M.P. Wasserstein, Morbidity and mortality in type B Niemann-Pick disease. Genet Med, 2013. 15(8): p. 618-23.
4. McGovern, M.M., T. Pohl-Worgall, R.J. Deckelbaum, et al., Lipid abnormalities in children with types A and B Niemann Pick disease. J Pediatr, 2004. 145(1): p. 77-81.
5. Orchard, E.A., D. Kempson, and D.C. Lindsay, Niemann-Pick disease type B with severe coronary artery disease and early recurrence after coronary artery bypass grafting. J Clin Lipidol, 2009. 3(1): p. 57-8.
6. McGovern, M.M., N. Lippa, E. Bagiella, E.H. Schuchman, R.J. Desnick, and M.P. Wasserstein, Morbidity and mortality in type B Niemann–Pick disease. Genetics in Medicine, 2013. 15(8): p. 618-623.