Raimondo Pittorru1, Pietro Bernardo Dall’Aglio1, Pasquale Valerio Falzone1, Vittorio Zuccarelli1, Enrico Fantini1, Michelangelo Siliberti1, Michele Nori1, Patrizia Aruta1, Antonella Cecchetto1, Domenico Catanzariti2, Gino Gerosa1, Federico Migliore1.
1Dipartimento di Scienze Cardio-Toraco-Vascolari, Università degli Studi di Padova
2Divisione di Cardiologia, Ospedale Santa Maria del Carmine, Rovereto
Abstract: La stimolazione della branca sinistra sta emergendo come una modalità di stimolazione del sistema di conduzione alternativa a quella hissiana grazie alla sua capacità di garantire soglie basse e stabili. Tuttavia i dati sulle complicanze a medio/lungo termine e sulla sicurezza di un’eventuale estrazione sono limitati. Riportiamo il caso di una giovane ragazza, affetta da scompenso cardiaco in un quadro di cardiomiopatia dilatativa con severa disfunzione biventricolare, sottoposta ad estrazione transvenosa di elettrocateteri per insufficienza tricuspidale dieci mesi dopo l’impianto.
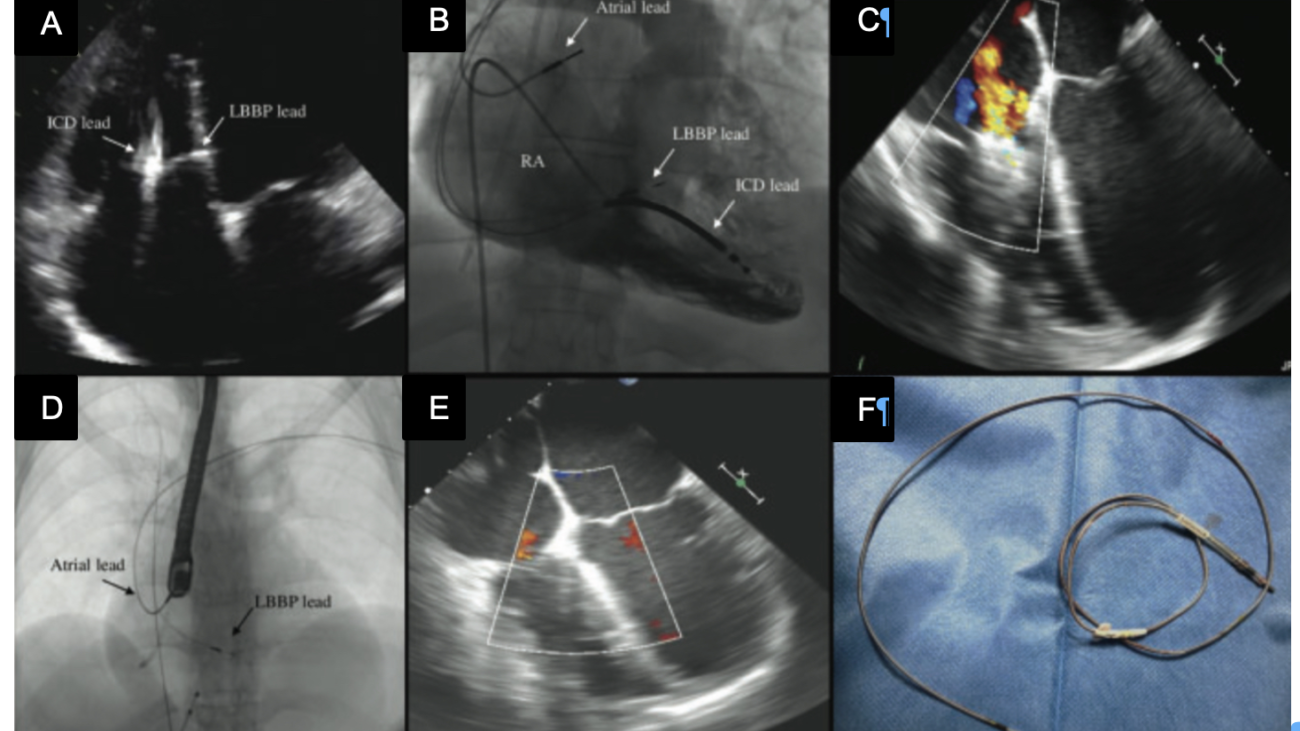
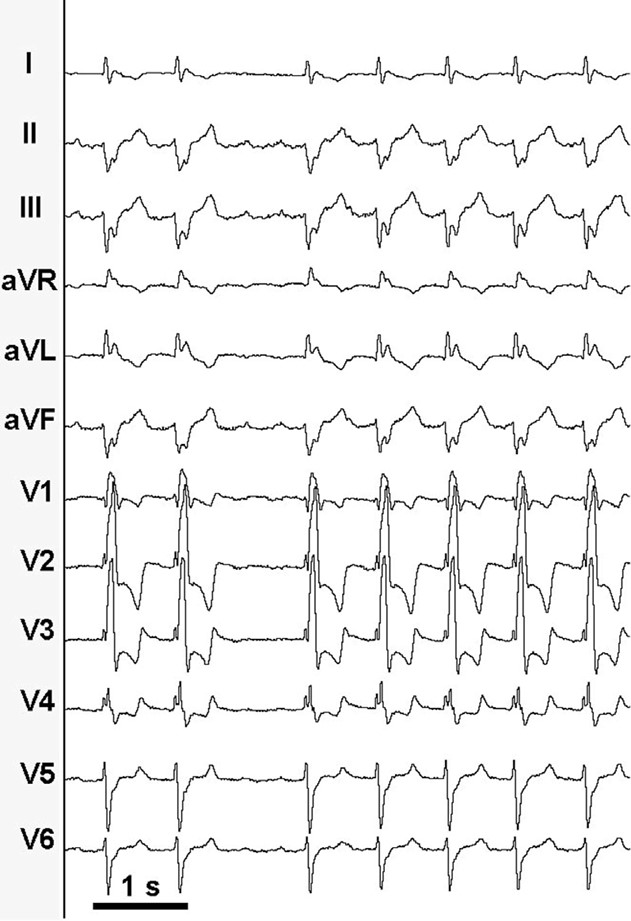
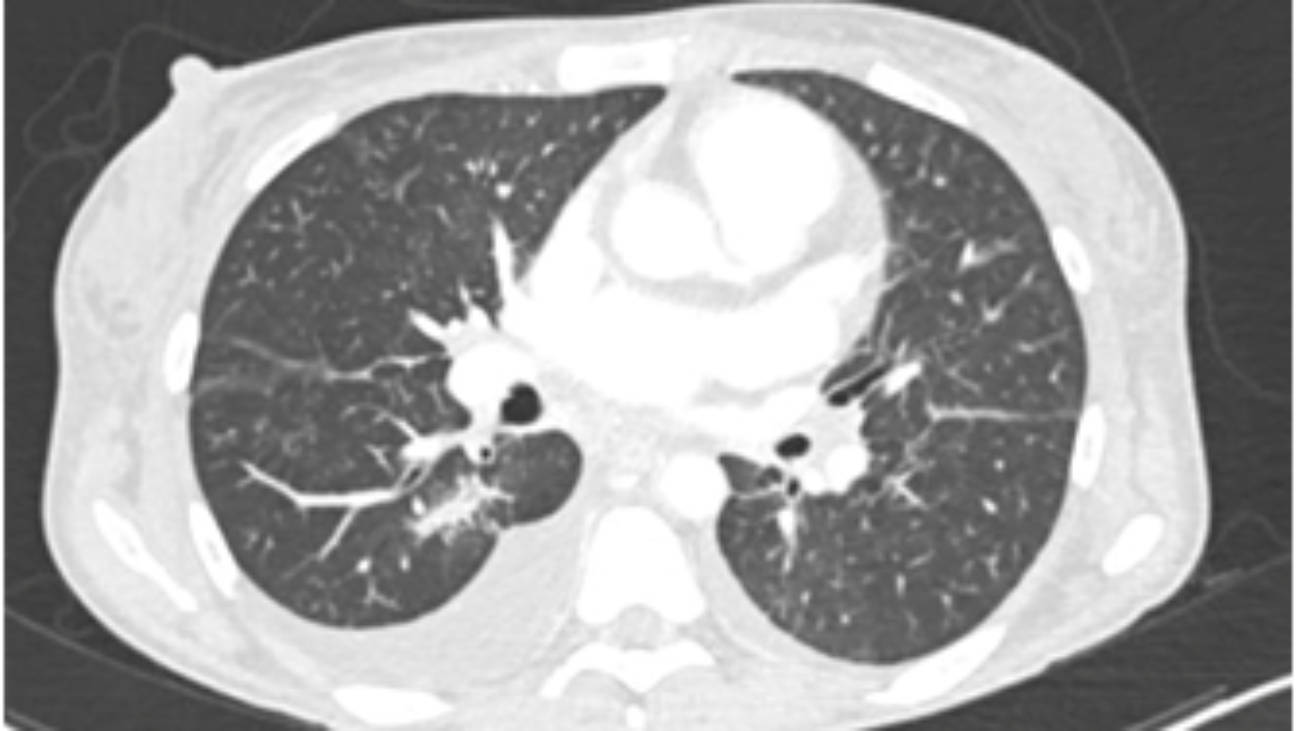
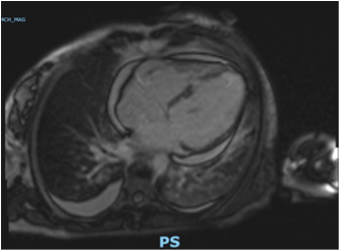
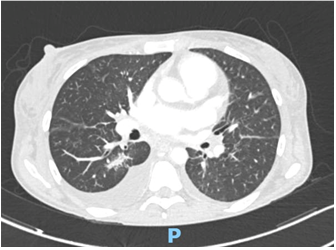
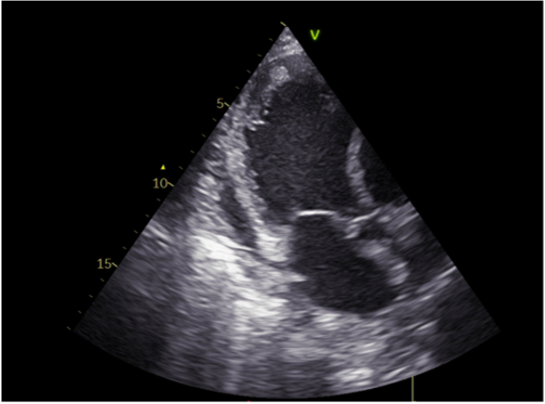
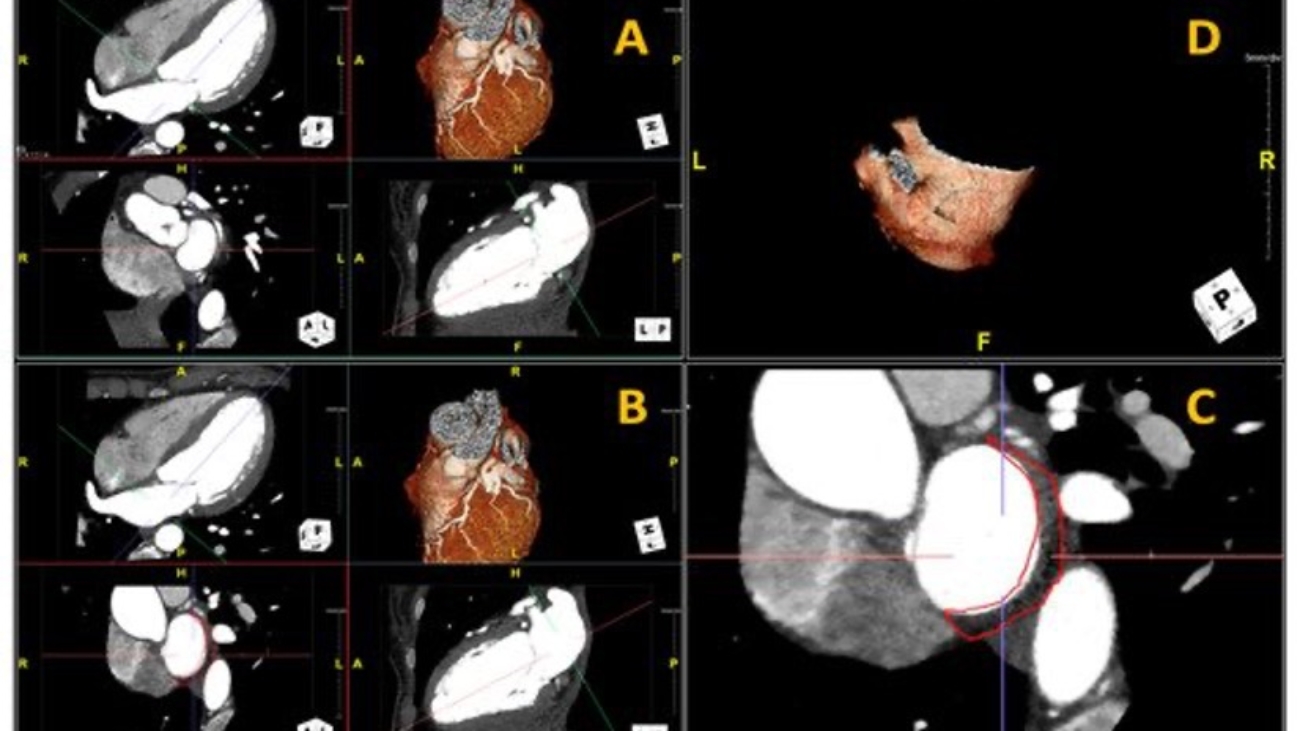
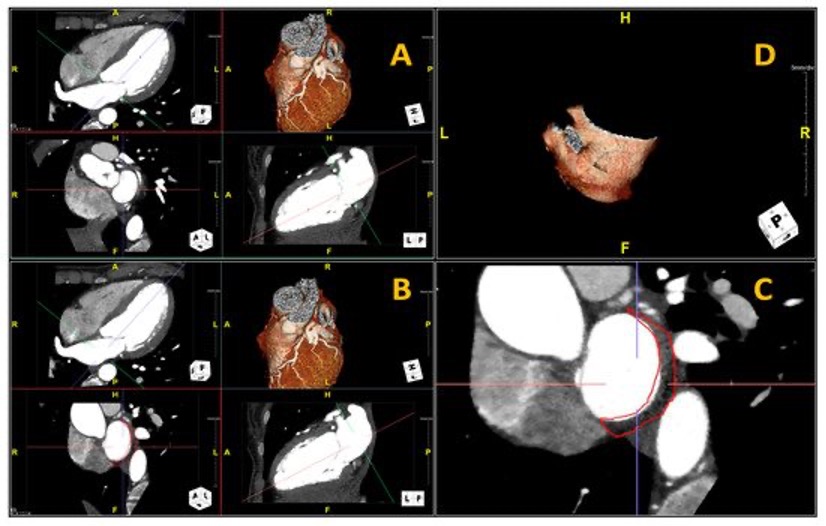
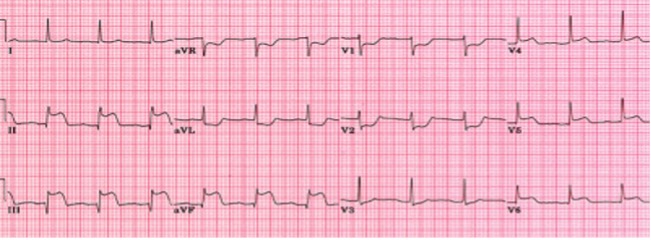
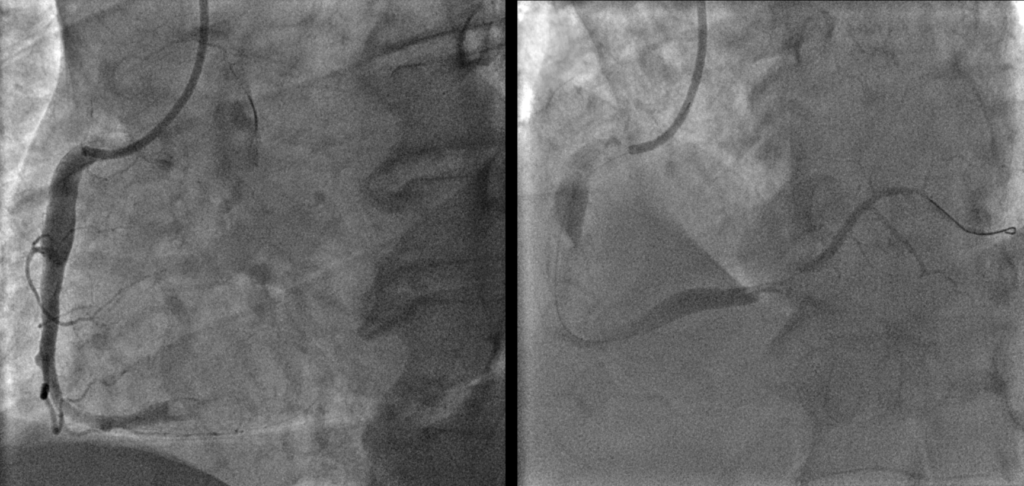
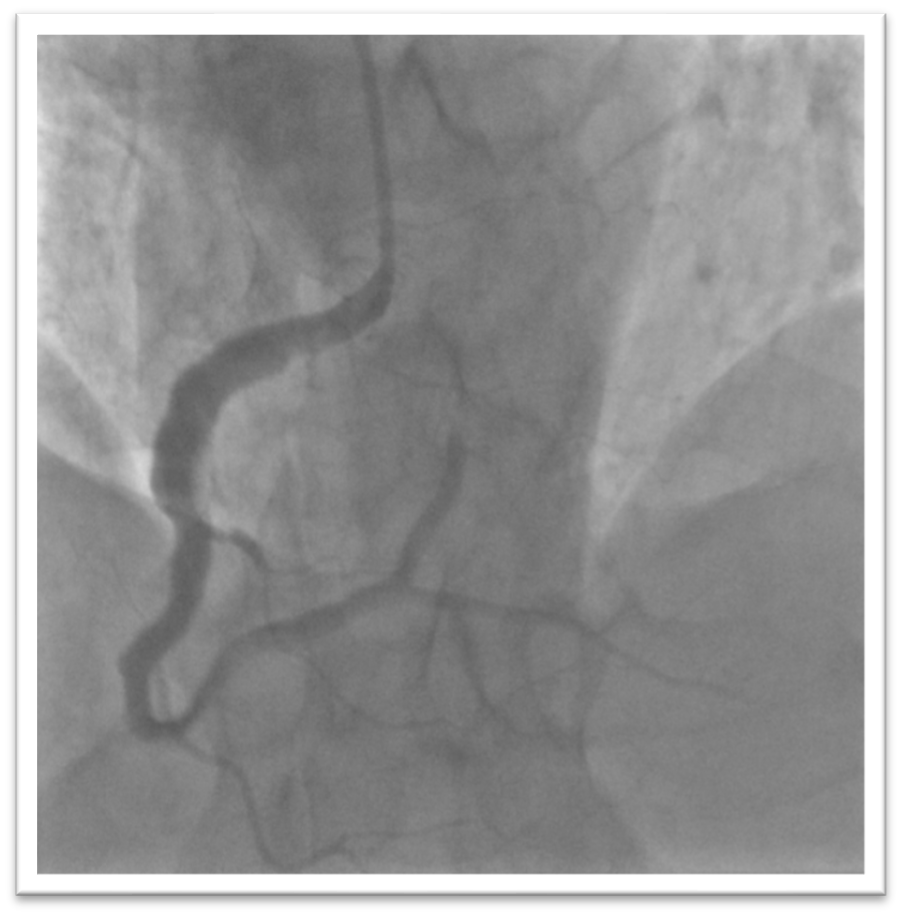
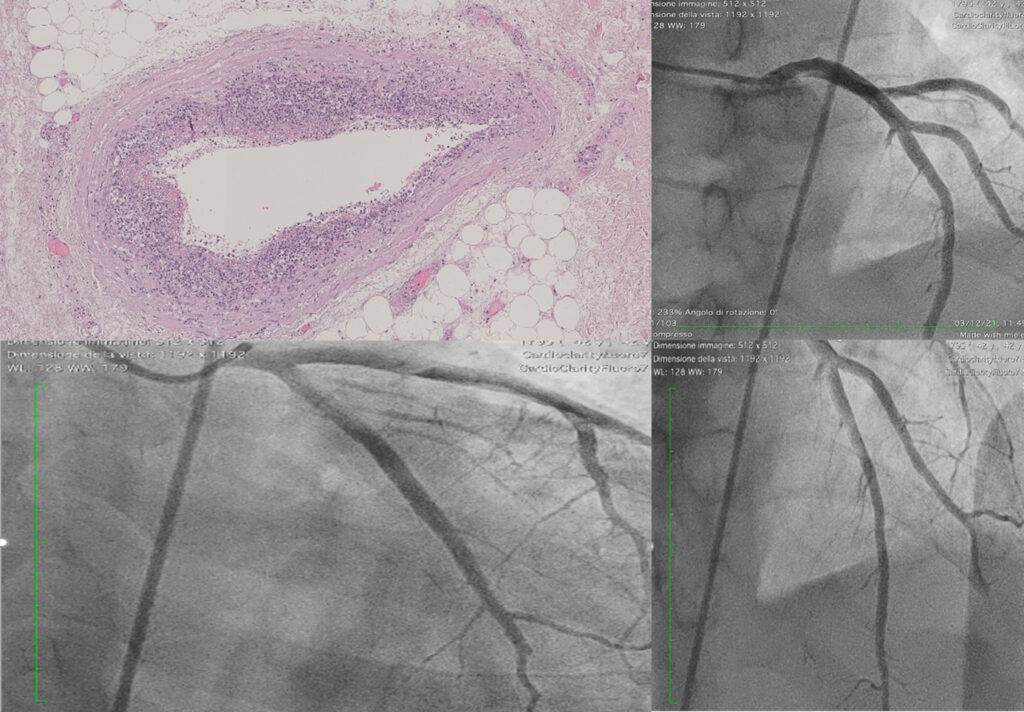
Caso clinico: Una donna di 28 anni, affetta da cardiomiopatia dilatativa con severa disfunzione biventricolare, veniva sottoposta a terapia di resincronizzazione mediante pacing di branca sinistra come alternativa alla terapia convenzionale nel gennaio 2020. La stimolazione della branca sinistra veniva effettuata mediante utilizzo del catetere SelectSecure 3830, 69cm (Medtronic Inc., Minneapolis, MN, USA) attraverso approccio transettale ventricolare. Il catetere veniva posizionato nel setto muscolare a circa 2 cm dalla regione hissiana (figura 1 A-B). Venivano inoltre posizionati un elettrocatetere atriale passivo ed un ICD single-coil attivo in sede apicale per la prevenzione della morte cardiaca improvvisa, vista la giovane età. Dopo alcuni mesi, nonostante l’introduzione di terapia medica ottimizzata, andava incontro ad un sensibile peggioramento dello scompenso cardiaco clinicamente destro caratterizzato da edemi declivi, turgore giugulare ed ascite complicata da episodi ricorrenti di peritonite batterica spontanea. Giungeva alla nostra attenzione 10 mesi dopo l’impianto per approfondimento del quadro clinico. L’ecocardiogramma mostrava una severa dilatazione del ventricolo sinistro (VTDi 100ml/mq) con una frazione di eiezione moderatamente ridotta (FE 36%) in presenza di ipocinesia diffusa. Si documentava inoltre un’insufficienza tricuspidale severa che riconosceva un meccanismo misto: dilatazione dell’annulus e mal-coaptazione dei lembi posteriore e settale per interferenza degli elettrocateteri (figura 1C). Dopo valutazione multidisciplinare, si condivideva di trattare l’insufficienza tricuspidale mediante rimozione transvenosa degli elettrocateteri. La procedura veniva eseguita in sala ibrida mediante guida ecocardiografica transesofagea. L’elettrocatetere dell’ICD veniva rimosso mediante trazione manuale con utilizzo di stiletto autobloccante. L’elettrocatetere da pacing di branca sinistra veniva rimosso mediante trazione manuale applicando fini movimenti bidirezionali sotto guida ecocardiografia transesofagea (figura 1D). Infine l’elettrocatetere atriale veniva estratto tramite sheat meccanica rotazionale (Cook Medical, Evolution RL). Si otteneva quindi un successo procedurale completo. Ai parametri ecocardiografici intra-operatori non si documentava nessuno shunt interventricolare in sede di applicazione dell’elettrocatetere per la branca sinistra (figura 1E); era invece apprezzabile un miglioramento dell’insufficienza tricuspidale. La paziente andava incontro, tuttavia, a scompenso cardiaco avanzato, refrattario alla terapia medica con peggioramento dell’insufficienza tricuspidale e veniva, infine, sottoposta a trapianto cardiaco.
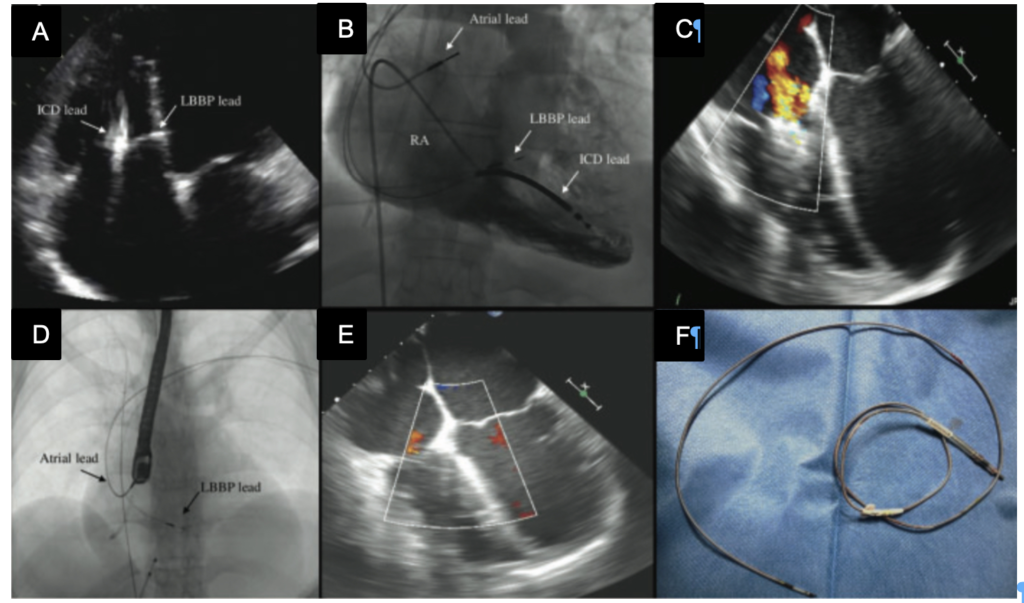
Modified by F.Migliore et al, EuroPace. 2021 Dec 7;23(12):1921
Figura: Ecocardiogramma 4-camere dove si vede il catetere LBBP a livello del setto interventricolare (A). Ventricolografia destra che mostra gli elettrocateteri e l’insufficienza tricuspidale severa (B). Ecocardiogramma transesofageo (ETE) intraprocedurale che documenta l’insufficienza tricuspidale severa legata agli elettrocateteri (C). Fluoroscopia intraprocedurale che mostra la rimozione del catetere da stimolazione della branca sinistra mediante trazione manuale (D). ETE post-procedurale che non evidenzia shunt residui a livello del setto interventricolare (E). Il catetere da stimolazione della branca sinistra rimosso che non presenta fibrosi nella tip distale (F).
Discussione: Gli elementi sui quali si incentra la discussione sono sostanzialmente tre: il ruolo della stimolazione di branca sinistra (LBBP) oggigiorno; l’originalità del caso che prevede la rimozione del catetere deputato alla stimolazione della branca sinistra dopo dieci mesi; l’insufficienza tricuspidale secondaria anche all’interferenza degli elettrocateteri. Nel panorama elettrofisiologico la stimolazione hissiana, che ha come target la stimolazione del sistema di conduzione cardiaco nativo, è un pacing fisiologico accettato. Tuttavia, ha alcune limitazioni, fra le quali la difficoltà operativa ed il raggiungimento di soglie di pacing più elevate. Recentemente la stimolazione della branca sinistra attraverso un approccio trans-settale ventricolare è emerso come un’alternativa di stimolazione fisiologica e per la correzione del blocco di branca, con una soglia di cattura più bassa e stabile e una durata del QRS relativamente stretta grazie alla rapida attivazione ventricolare sinistra.
La necessità di penetrazione dell’elettrocatetere all’interno del setto interventricolare per il reclutamento della branca sinistra desta preoccupazioni circa la sicurezza ed efficacia dell’estrazione qualora si rendesse necessaria in futuro. Una delle preoccupazioni è l’impossibilità di introdurre uno stiletto all’interno del lume di questi elettrocateteri necessario per garantire una trazione efficace durante la procedura di estrazione. E’ noto che la presenza di più elettrocateteri possa impedire una corretta coaptazione dei lembi della valvola tricuspide determinando un’insufficienza anche rilevante. Il caso clinico offre a considerare che l’insufficienza tricuspidale può essere non soltanto una complicanza dell’estrazione ma essere causata dall’interferenza degli elettrocateteri.
Conclusioni: Il nostro caso clinico dimostra che la rimozione transvenosa dell’elettrocatetere deputato alla stimolazione della branca sinistra sembra essere sicura ed efficace anche dopo dieci mesi, senza evidenza di shunt residuo a livello del setto interventricolare. Questo rappresenta il caso clinico con durata di permanenza di elettrocatetere (dwelling-time) da stimolazione della branca sinistra più lungo riportato in letteratura. In futuro, bisognerà raccogliere maggiori dati circa la sua fattibilità tecnica, considerando anche la loro peculiarità e la corretta sequenza di estrazione in caso di presenza di più elettrocateteri.
caso clinico