L’impatto della ventilazione a pressione positiva continua sulla meccanica cardiaca: risultati di una meta-analisi di studi ecocardiografici.
Marijana Tadic MD, PhD1 *; Elisa Gherbesi MD2; Andrea Faggiano MD2; Carla Sala MD2; Stefano Carugo MD2; Cesare Cuspidi MD3
1 University Clinical Hospital Centre “Dragisa Misovic”, Belgrade, Serbia.
2 Department of Clinical Sciences and Community Health, University of Milano and
Fondazione Ospedale Maggiore IRCCS Policlinico di Milano, Milan, Italy.
3 Department of Medicine and Surgery,University of Milano-Bicocca, Milano, Italy
*Correspondence
Marijana TadicMD, PhD, University Hospital “Dr. DragisaMisovic – Dedinje”, Department of Cardiology, Heroja Milana Tepica 1, Belgrade 11000, Serbia.
Email: marijana_tadic@hotmail.com
Pubblicazione : Aprile 2022 sul Journal of Clinical Hypertension, 2022;1-9. DOI: 10.1111/jch.14488 1
Abstract :
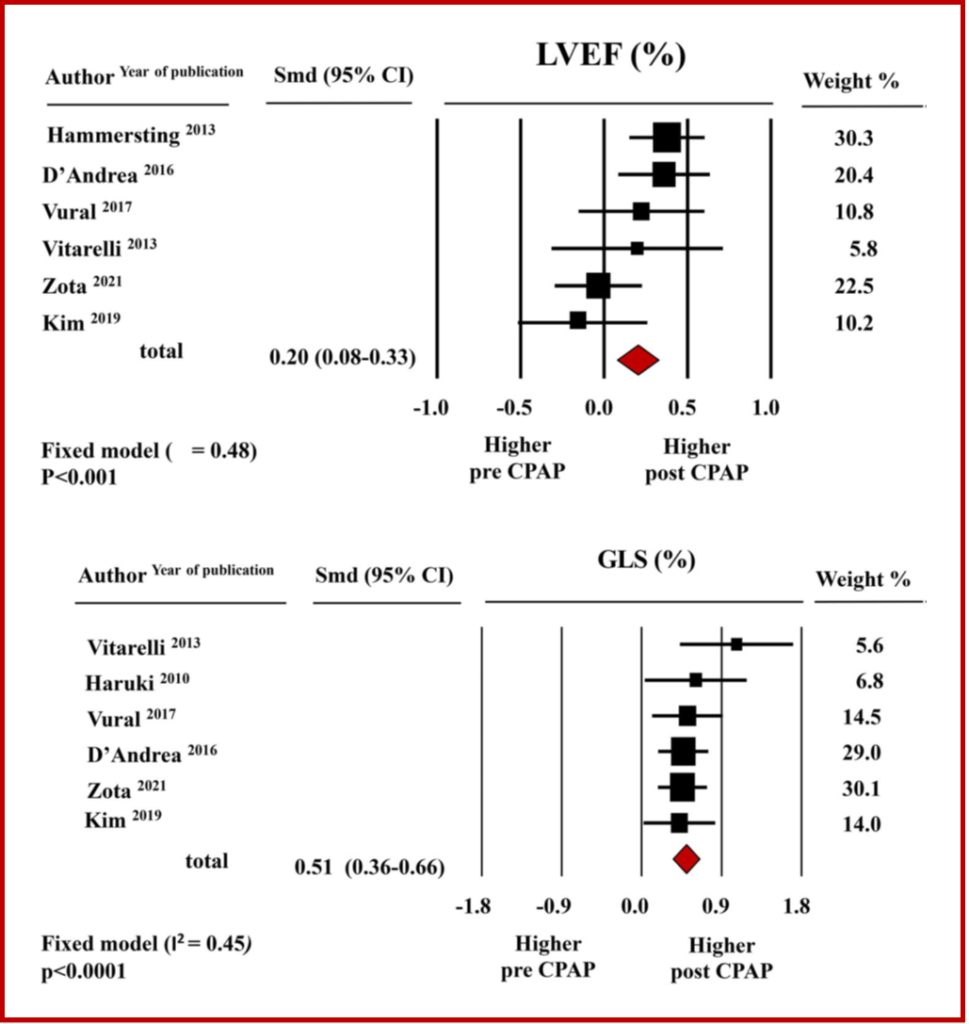
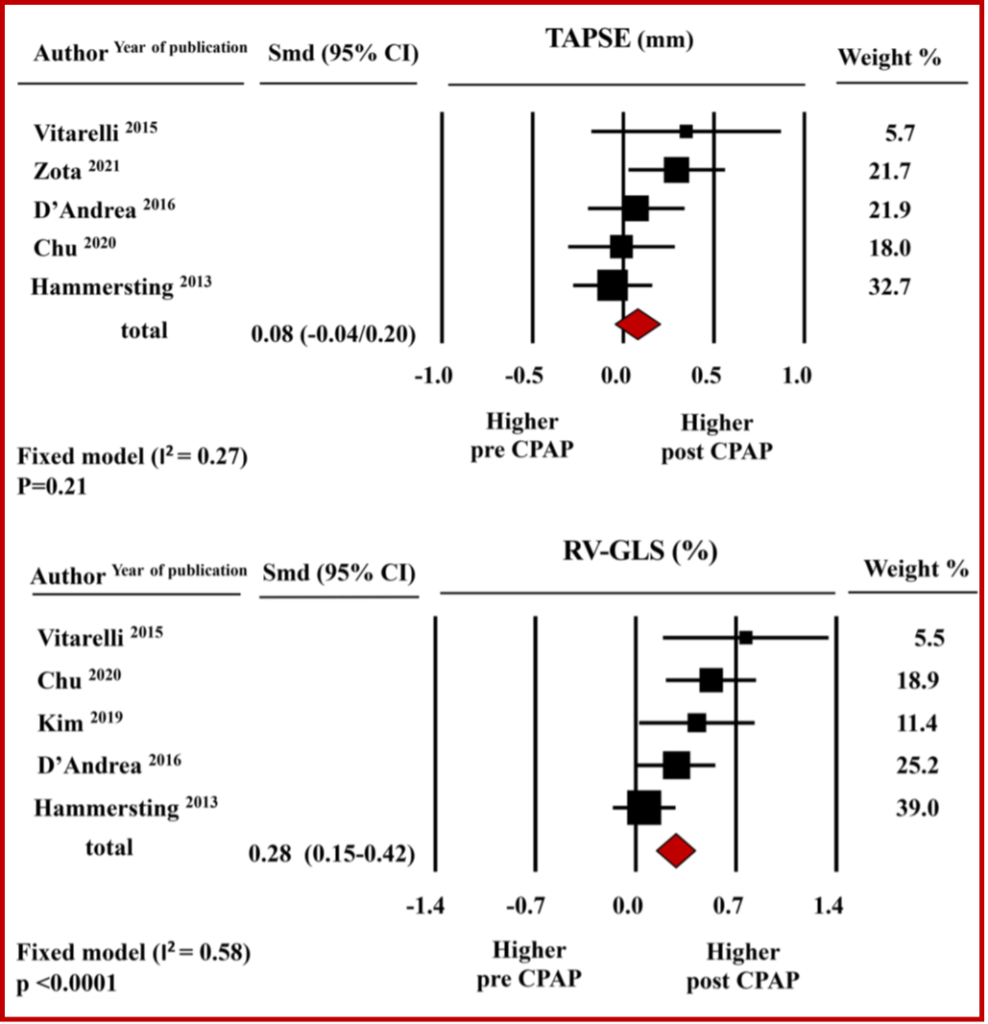
L’effetto della ventilazione a pressione positiva (CPAP) sulla meccanica cardiaca nei pazienti affetti da sindrome delle apnee ostruttive del sonno (OSAS) è ignoto. E’ stata condotta una metanalisi degli studi di ecocardiografia “speckle-tracking” che fornissero informazioni sulla meccanica del ventricolo sinistro (LV) e del ventricolo destro (RV), valutata mediante global longitudinal strain (GLS). La metanalisi, che includeva 337 pazienti con OSAS afferenti a 9 studi, ha mostrato un miglioramento significativo sia del LV-GLS ( SMD: 0.51±0.08; CI0.36-0.66), p=0.0001) che della frazione d’eiezione (LVEF; SMD: 0.20±0.06,CI:0.08–0.33, p = 0.001 ) dopo CPAP. Invece, per quanto concerne la funzione sistolica del RV, dopo CPAP si è assistito ad un miglioramento significativo limitato al RV-GLS (SMD: 0.28±0.07, CI:0.15–0.42, p = 0.0001) e non all’escursione sistolica del piano dell’anello tricuspidale (TAPSE; SMD 0.08±0.06, CI: -0.04/0.20, p = 0.21). In conclusione, nella valutazione dei pazienti affetti da OSAS l’ecocardiografia “speckle-tracking” permette di individuare alterazioni subcliniche della funzione sistolica e di monitorarne la risposta alla terapia con CPAP.
Articolo
La sindrome delle apnee ostruttive del sonno, una patologia sempre più diffusa e rilevante, è associata ad un aumentato rischio di eventi cardiovascolari e di mortalità per tutte le cause 2. La terapia con CPAP è raccomandata dalle linee guida come prima linea di trattamento nei pazienti affetti da OSAS di grado moderato e severo, e anche in coloro con OSAS lieve in cui le modifiche comportamentali si sono rivelate insufficienti 3. Numerosi studi hanno dimostrato che la CPAP, riducendo gli episodi ipossici notturni, comporta un miglioramento dei parametri emodinamici (ad es. pressione arteriosa, rigidità vascolare), ormonali (ad es. catecolamine) e cardio-metabolici (ad.es sindrome metabolica) 4. Non vi è invece chiara evidenza sul fatto che la CPAP possa migliorare la funzione cardiaca. Questo potrebbe essere anche imputabile al fatto che i canonici indici ecocardiografici utilizzati per esprimere la funzione biventricolare ( ad es. LVEF, TAPSE, FAC, S’) non siano sufficientemente sensibili nell’individuare modifiche subcliniche della funzione cardiaca. Il GLS, valutando la meccanica miocardica segmentaria, potrebbe invece essere in grado di rilevare modifiche subcliniche 5. Per tale motivo è stata condotta una metanalisi degli studi di ecocardiografia “speckle-tracking” che fornissero informazioni sulla meccanica miocardica biventricolare, valutata mediante GLS.
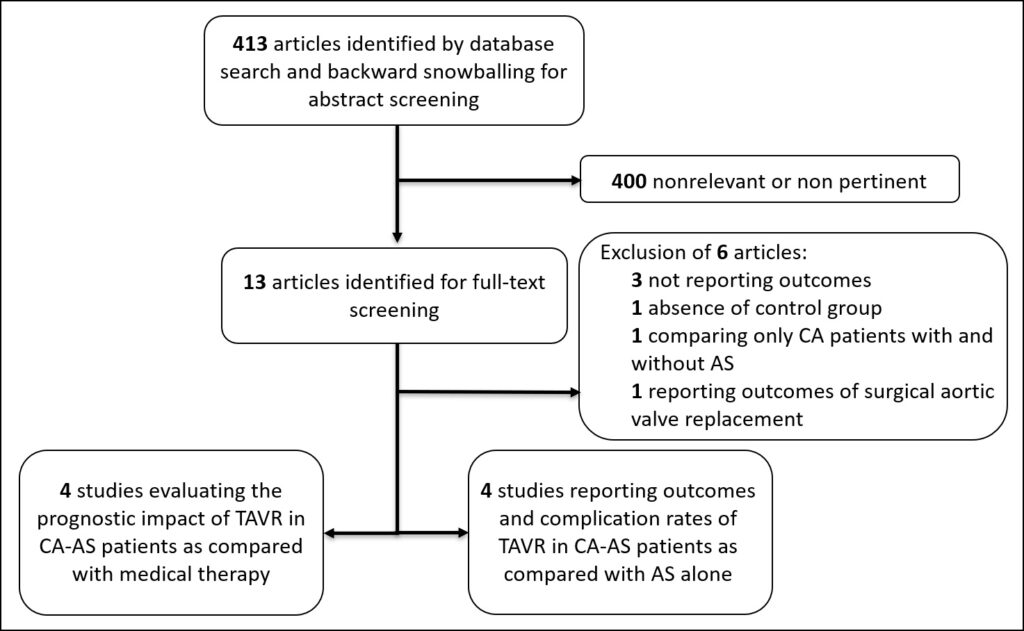
Tramite revisione sistematica ed analisi metanalitica, è stato possibile identificare 9 studi osservazionali ed un totale di 337 pazienti affetti da OSAS sottoposti a terapia con CPAP. La tabella 1 mostra i dati principali degli studi inclusi.
| Author Year publication | OSA sample size (n) | CPAP duration (months) | Baseline AHI (h) | Final AHI (h) | Setting | Outcome |
| Haruki 2010 | 14 | 3 | 56+19 | 5+8 | Moderate to severe OSA without CV disease | LV GLS |
| Hammersting 2013 | 82 | 6 | 31+27 | 6+7 | Mild to severe OSA with prevalent CV disease | RV GLS |
| Vitarelli 2013 | 15 | 4 | 59±9 | 4±2 | Severe OSA without comorbidities | LV GLS |
| Vitarelli 2015 | 15 | 4 | 58+9 | 4+2 | Severe OSA without comorbidities | RV GLS |
| D’Andrea 2016 | 55 | 6 | 35+15 | 5+8 | Mild to severe OSA without CV disease | LV and RV GLS |
| Vural 2017 | 28 | 24 | na | na | Mild to severe OSA without pulmonary and CV disease | LV GLS |
| Kim 2019 | 26 | 3 | na | na | Severe OSA without CV disease | LV and RV GLS |
| Chou 2020 | 45 | 24 | 50+16 | 5+2 | Severe OSA without CV disease | RV GLS |
| Zota 2021 | 57 | 2 | 42+21 | na | Moderate to severe OSA with prevalent HTN, DM and obesity | LV GLS |
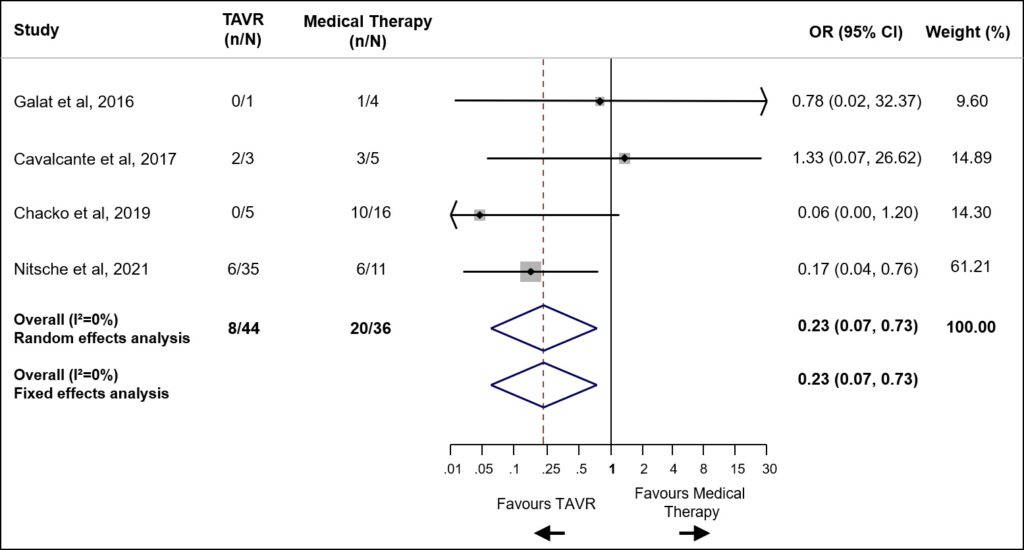
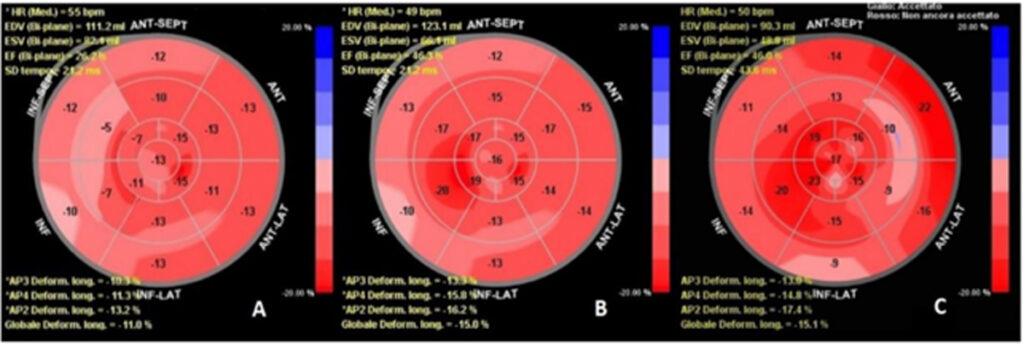
Dalla metanalisi emerge che per quanto riguarda la funzione del ventricolo sinistro, la terapia con CPAP permette un miglioramento significativo, osservabile sia mediante LVEF che GLS. Precisamente, i valori medi aggregati di LVEF incrementavano dal 59.9% ±1.6% del baseline al 61.9% ± 0.9% dopo terapia con CPAP , con una differenza media standardizzata (SMD) significativa (SMD 0.20±0.06, CI 0.08/0.33, p < 0.001). L’incremento della funzione ventricolare sinistra dopo CPAP risulta ancora più marcato quando oggettivato mediante LV-GLS ( -17.7%±0.6% al baseline versus -19.6%±0.4% al follow-up) pari ad una SMD: 0.51±0.08, (CI 0.36/-0.66, p < 0.0001). Figura 1.
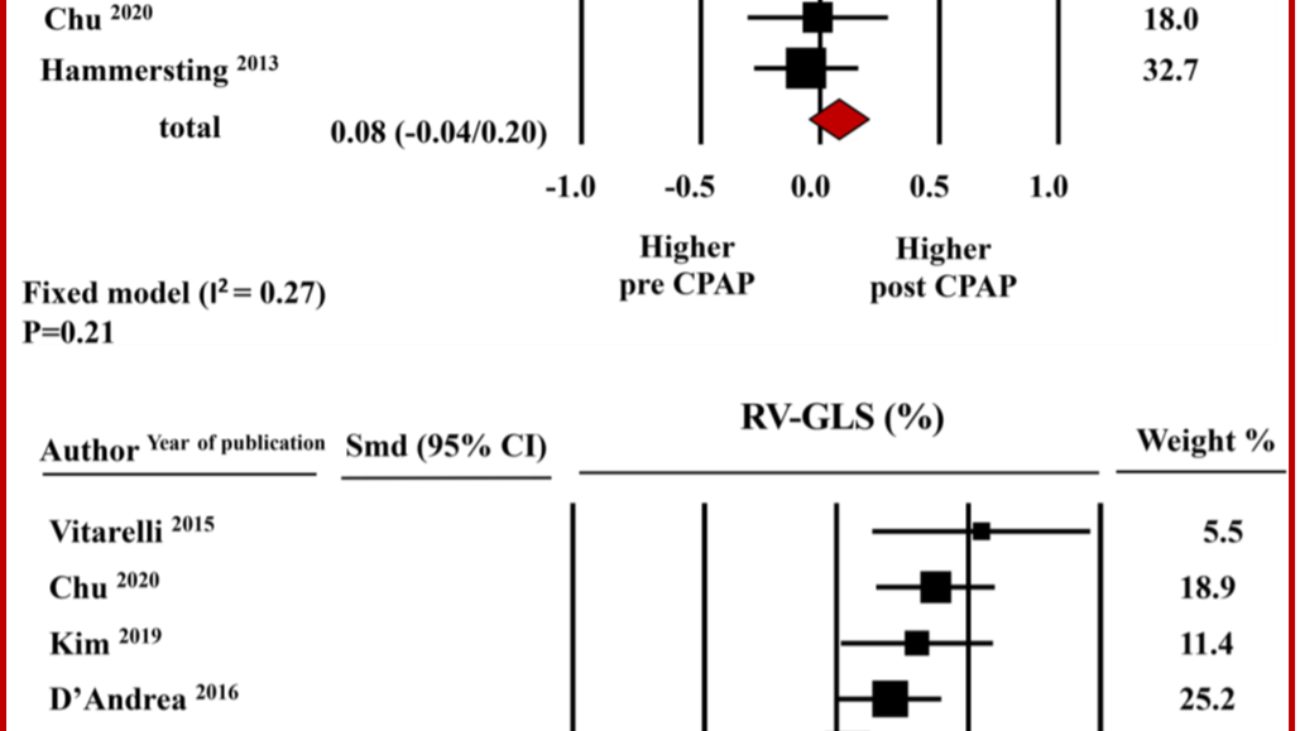
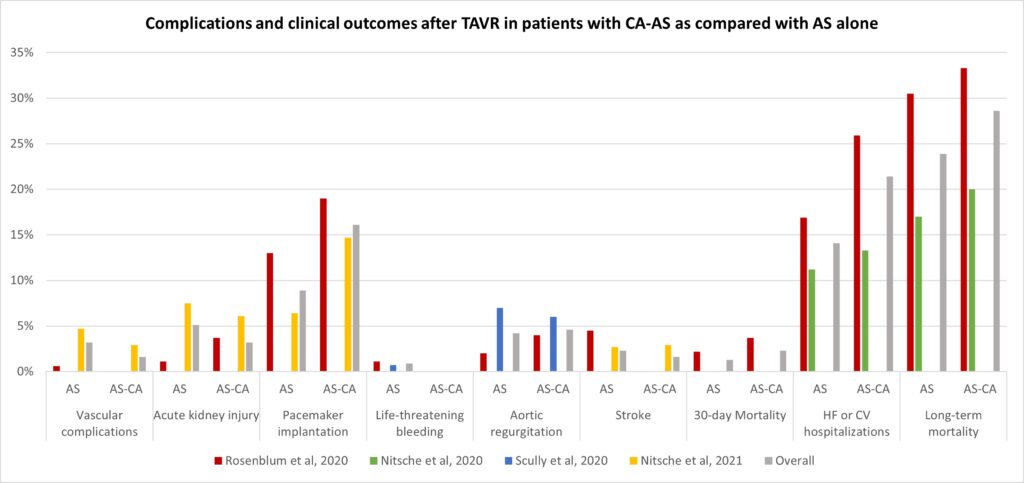
Riguardo la funzione ventricolare destra, la metanalisi non ha documentato modifiche significative del TAPSE, i cui valori medi aggregati corrispondevano a 21.8 mm ± 1.3 mm prima e 21.1 mm ± 1.2 mm dopo terapia con CPAP ( SMD: 0.08±0.06, CI-0.04/0.20,p = 0.21). Invece, dalla metanalisi emerge un miglioramento significativo della meccanica ventricolare destra oggettivato dall’incremento del RV-GLS da -17.7±1.32% a -19.3±1.7% con una differenza media standardizzata pari a 0.28±0.07, CI 0.15/0.42, p < 0.0001). Figura 2 (Figura chiave)
Discussione e Conclusioni
Nei pazienti affetti da OSAS, i meccanismi sottostanti il miglioramento della funzione biventricolare indotto dalla terapia con CPAP sembrerebbero essere relati alla:
- Riduzione della pressione negativa intratoracica. Tale meccanismo comporta una riduzione del ritorno venoso, del postcarico del ventricolo sinistro e del precarico del ventricolo destro.
- Riduzione degli eventi ipossici ed ipercapnici. Tale meccanismo comporta un’inibizione dell’attività ortosimpatica che a sua volta determina una riduzione della vasocostrizione periferica, della rigidità arteriosa di parete, della vasocostrizione ipossica del circolo polmonare e del postcarico del ventricolo destro.
I risultati della nostra metanalisi sottolineano la necessità di includere il LV-GLS e RV-GLS nella valutazione ecocardiografica di routine dei pazienti affetti da OSAS in modo da definire l’eventuale livello di disfunzione subclinica biventricolare. Infatti, LV-GLS e RV-GLS appaiono più sensibili dei convenzionali parametri ecocardiografici (LVEF e TAPSE, rispettivamente) nell’individuare fini cambiamenti della funzione sistolica nei pazienti affetti da OSAS, sia al basale che durante terapia con CPAP, permettendo così di ottenere un’affidabile valutazione riguardo l’efficacia della terapia e della compliance del paziente alla stessa.
Bibliografia
1. Marijana Tadic MD P 1 EGMAFM 2, Carla Sala MD 2 Stefano Carugo MD1 Cesare Cuspidi MD 3. The impact of continuous positive airway pressure on cardiac mechanics: Findings from a meta-analysis of echocardiographic studies. J Clin Hypertens. 2022. doi:10.1111/jch.14488
2. Jennum P, Tønnesen P, Ibsen R, Kjellberg J. Obstructive sleep apnea: effect of comorbidities and positive airway pressure on all-cause mortality. Sleep Med. 2017;36. doi:10.1016/j.sleep.2017.04.018
3. Erratum: Obstructive sleep apnoea/hypopnoea syndrome and obesity hypoventilation syndrome in over 16s: Summary of NICE guidance (BMJ (2021) 375 (n2360) DOI: 10.1136/bmj.n2360). BMJ. 2022;376. doi:10.1136/bmj.o619
4. Green M, Ken-Dror G, Fluck D, et al. Meta-analysis of changes in the levels of catecholamines and blood pressure with continuous positive airway pressure therapy in obstructive sleep apnea. J Clin Hypertens. 2021;23(1). doi:10.1111/jch.14061
5. Tadic M, Cuspidi C, Grassi G, Mancia G. Obstructive sleep apnea and cardiac mechanics: how strain could help us? Heart Fail Rev. 2021;26(4). doi:10.1007/s10741-020-09924-0