Carmen Spaccarotella1, Annalisa Mongiardo1, Sabato Sorrentino1, Alberto Polimeni1, Maria Petullà2, Salvatore De Rosa1, Ciro Indolfi1
1 Divisione di Cardiologia, Centro di Ricerche delle Malattie Cardiovascolari, Università degli Studi “Magna Graecia”, Catanzaro
2 Divisione di Radiologia, Università degli Studi “Magna Graecia”, Catanzaro
ABSTRACT
Presentiamo il caso di un paziente con stenosi aortica severa e calcificazioni diffuse a livello degli accessi vascolari periferici sottoposto a sostituzione valvolare aortica percutanea (TAVI), per il quale l’impianto di una valvola self-expandable da 34 mm è risultato possibile solo dopo l’utilizzo della litotrissia intravascolare (IVL). Dopo l’efficace posizionamento della protesi valvolare, tuttavia, è stata notata una importante complicanza coinvolgente il sito di accesso arterioso, che ha reso necessario l’impianto di uno stent ricoperto a livello dell’arteria femorale.
CASO
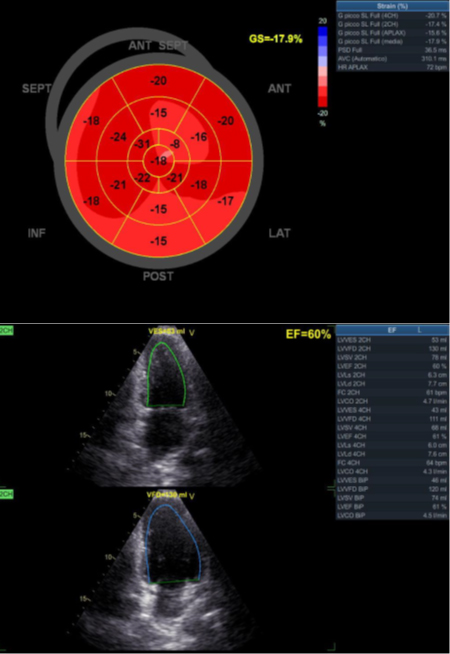
Un uomo di 82 anni, con anamnesi positiva per ipertensione arteriosa, fibrillazione atriale permanente, diabete mellito di tipo 2, BPCO severa, ateromasia carotidea e pregressa abitudine tabagica, già sottoposto ad intervento di protesi d’anca destra, veniva ricoverato presso il nostro centro con sintomi di scompenso cardiaco di classe NYHA 3, tra cui soprattutto la dispnea da sforzo lieve. L’ecocardiogramma all’ingresso documentava: stenosi valvolare aortica di grado severo (con gradiente medio 48 mmHg ed area valvolare 0,7 cm2), dilatazione dell’atrio sinistro, insufficienza mitralica di grado moderato, ipertensione polmonare di grado severo (PAPs 75 mmHg) e lieve riduzione della funzione sistolica del ventricolo sinistro (FE 52%). Data l’età avanzata del paziente e le numerose comorbidità, l’Heart Team optava per una sostituzione valvolare aortica di tipo percutaneo (TAVI).
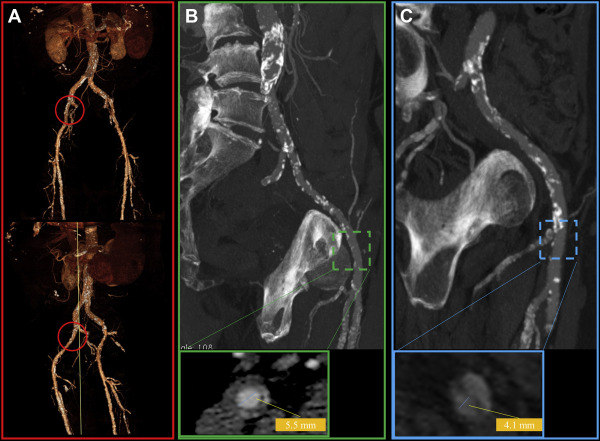
Si procedeva pertanto all’esecuzione di una angioTC per la valutazione delle dimensioni valvolari e dell’eventuale presenza di malattia coronarica e/o di stenosi a livello degli accessi vascolari periferici. Come mostrato nella fig. 1, l’arteria femorale comune destra presentava diffusa ateromasia calcifica con placche circonferenziali responsabili di una importante riduzione del lume vasale (diametro minimo 4,1 mm) e con evidenza di ulcera penetrante aterosclerotica (fig. 1C). L’arteria femorale controlaterale, nonostante la presenza di ateromasia calcifica, non mostrava invece particolari tortuosità ed aveva un diametro vasale accettabile (diametro minimo 5,5 mm) (fig. 1B).
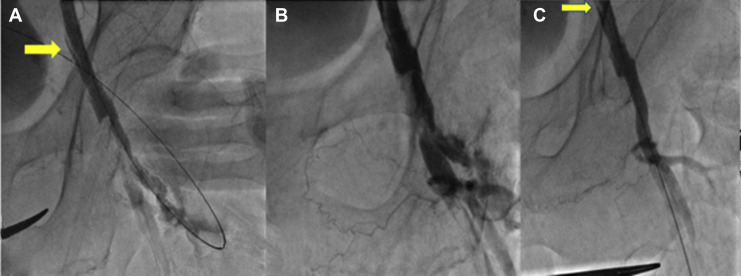
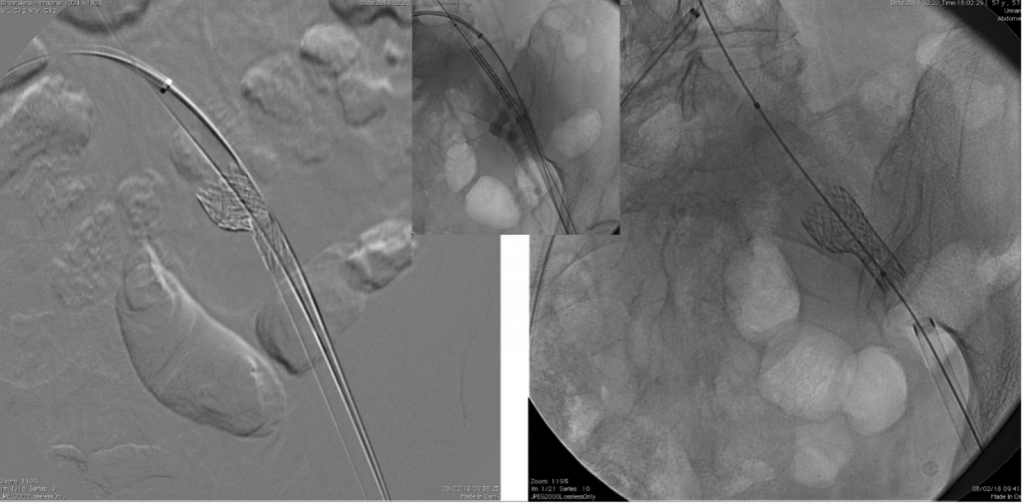
Alla luce di questi riscontri, e dato che l’annulus valvolare risultava essere di 92 mm, si optava per l’impianto di una valvola self-expandable da 34 mm (Medtronic Evolut R) e per l’utilizzo dell’arteria femorale comune sinistra come sito di accesso principale; il vaso di destra veniva invece esclusivamente utilizzato per il posizionamento di un safety wire per l’asse controlaterale. Durante questo step si procedeva alla verifica del corretto posizionamento della guida nell’arteria femorale superficiale e non si notavano dissezioni o rotture della parete vasale. Tuttavia, data l’impossibilità di attraversare l’arteria femorale comune con il sistema di delivery per la valvola scelta, sia in presenza che in assenza dello sheath, si decideva di utilizzare la litotrissia intravascolare (IVL) con sistema Shockwave per ridurre le stenosi. Si procedeva quindi a quattro cicli di IVL utilizzando un pallone 7 x 60 mm dilatato fino a 6 atm; al termine degli stessi, risultava quindi possibile il superamento della criticità e si riusciva ad impiantare con successo la protesi valvolare attraverso un introduttore 20 F (fig. 2).
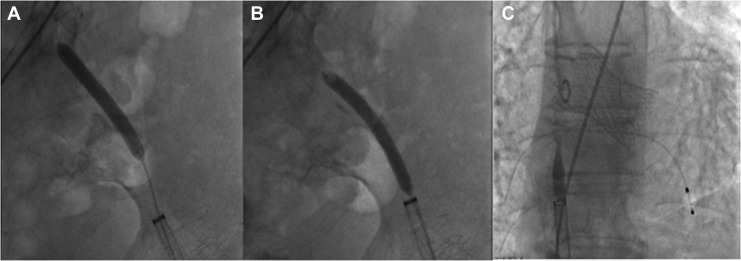
Tuttavia, nella fase conclusiva della procedura, alla luce dell’inefficacia di due sistemi di chiusura Proglide, si procedeva all’esecuzione di un’angiografia periferica, che mostrava una lunga dissezione con origine a partire dal segmento distale dell’arteria iliaca esterna (fig. 3A) ed estensione fino al sito di accesso, con evidenza di rottura di parete (fig. 3B). Pertanto, si decideva di impiantare uno stent ricoperto Viabahn 7 x 50 mm nell’arteria femorale comune sinistra, seguito da multiple postdilatazioni con pallone 8 x 20 mm. Alla fine della procedura si notava la completa ricanalizzazione del vaso senza extravasazione di mezzo di contrasto, con persistenza della dissezione distale dell’arteria iliaca lontano dal sito di accesso (fig. 3C).
Il paziente veniva quindi trasferito presso la nostra UTIC in condizioni cliniche ed emodinamiche stabili; l’ecocardiogramma post-procedurale documentava il corretto posizionamento della protesi, ed il gradiente transvalvolare medio risultava essere di 7 mmHg. Dopo un totale di dieci giorni di degenza, ed in assenza di ulteriori complicanze degne di nota dopo l’intervento, il paziente veniva infine dimesso in buone condizioni di salute. Il follow-up clinico ed ecografico eseguito dopo sei mesi dimostrava buona pervietà dei vasi e perfusione degli arti, in assenza di sintomatologia.
DISCUSSIONE
La sostituzione valvolare aortica percutanea è una strategia efficace per il trattamento della stenosi aortica severa soprattutto nei pazienti a rischio più alto, e si è dimostrata superiore alla chirurgia quando eseguita utilizzando un sito di accesso arterioso transfemorale. (1-4) Tuttavia, un numero significativo di soggetti potrebbe non essere eleggibile per questo tipo di approccio a causa della presenza di vasculopatia periferica e/o severa ateromasia calcifica. L’utilizzo della litotrissia intravascolare, grazie alla riduzione delle calcificazioni a livello intimale e medio ed all’aumento della compliance vascolare, potrebbe permettere l’estensione dell’approccio transfemorale ad un gruppo più ampio di pazienti. (5-7) Nel caso in questione, questa tecnica ha permesso di procedere in maniera efficace all’impianto della protesi valvolare con un supporto di calibro importante (sheath da 20 F), nonostante la complessa anatomia.
La IVL non è però esente da complicanze, compresa la possibile dissezione del vaso, documentata in circa il 14,6% dei casi, di cui 0,9% portano a limitazione del flusso. (8) Nel nostro caso si è verificata una lunga dissezione a carico dell’asse iliaco-femorale e la rottura della parete dell’arteria femorale in prossimità del sito di accesso. La TAVI in pazienti che presentano vasi severamente calcifici e stenotici rimane una procedura di non semplice esecuzione anche con l’aiuto di devices che migliorano la compliance vascolare, e in alcuni casi potrebbe essere necessaria la riparazione di eventuali lesioni. L’utilizzo di stent ricoperti sull’asse vascolare iliaco-femorale può portare esso stesso ad ulteriori complicanze, come le trombosi e le restenosi intrastent, l’occlusione di vasi collaterali ed i difetti di perfusione a carico degli arti inferiori. Tuttavia, in situazioni di emergenza, l’approccio intravascolare permette nella maggioranza dei casi una efficace riparazione del danno ed una rapida riperfusione dell’arto. Inoltre, in casi come questo può essere utile l’inserzione di una guida nel vaso controlaterale, da poter utilizzare in caso di necessità.
BIBLIOGRAFIA
- Gargiulo G, Sannino A, Capodanno D, et al. Transcatheter aortic valve implantation versus surgical aortic valve replacement: a systematic review and meta-analysis. Ann Intern Med 2016; 165: 334–44.
- Spaccarotella C, Mongiardo A, De Rosa S, Indolfi C. Transcatheter aortic valve implantation in patients at intermediate surgical risk. Int J Cardiol 2017; 243: 161–8.
- Popma JJ, Deeb GM, Yakubov SJ, et al. Transcatheter aortic-valve replacement with a self-expanding valve in low-risk patients. N Engl J Med 2019; 380: 1706–15.
- Mack MJ, Leon MB, Thourani VH, et al. Transcatheter aortic-valve replacement with a balloon-expandable valve in low-risk patients. N Engl J Med 2019; 380: 1695–705.
- Brodmann M, Werner M, Holden A, et al. Primary outcomes and mechanism of action of intravascular lithotripsy in calcified, femoropopliteal lesions: results of Disrupt PAD II. Catheter Cardiovasc Interv 2019; 93: 335–42.
- Aksoy A, Salazar C, Becher MU, et al. Intravascular lithotripsy in calcified coronary lesions: a prospective, observational, multicenter registry. Circ Cardiovasc Interv 2019; 12: e008154.
- Gorla R, Cannone GS, Bedogni F, De Marco F. Transfemoral aortic valve implantation following lithoplasty of iliac artery in a patient with poor vascular access. Catheter Cardiovasc Interv 2019; 93: E140–2.
- Madhavan MV, Shahim B, Mena-Hurtado C, Garcia L, Crowley A, Parikh SA. Efficacy and safety of intravascular lithotripsy for the treatment of peripheral arterial disease: an individual patient level pooled data analysis. Catheter Cardiovasc Interv 2020; 95: 959–68.