Armando Ferrera1, Oreste Lanza1, Allegra Battistoni1, Massimo Volpe1
1 Dipartimento di medicina clinica e molecolare, Sapienza università di Roma
Abstract
Presentiamo il caso di un paziente di 66 anni senza fattori di rischio cardiovascolare noti né precedenti cardiologici di rilievo, portatore di catetere vescicale a permanenza, che accedeva in pronto soccorso con un quadro di embolia polmonare ad intermedio-alto rischio con rilievo di trombi flottanti nelle sezioni destre. Pur essendo il paziente emodinamicamente stabile, in considerazione del basso rischio emorragico e dell’alto carico trombotico, si decideva di discostarsi dalle indicazioni delle linee guida europee e di effettuare precocemente una trombolisi sistemica, con rapido beneficio clinico e strumentale.
Caso clinico
Un maschio di 66 anni, senza fattori di rischio cardiovascolare noti né precedenti cardiologici di rilievo, portatore di catetere vescicale a permanenza, accedeva presso il Pronto Soccorso del nostro ospedale per comparsa di febbre da alcuni giorni associata a dispnea ed un episodio presincopale.
All’ingresso il paziente si presentava emodinamicamente stabile, la pressione arteriosa era 110/70 mmHg, la frequenza cardiaca 101 battiti per minuto, la saturazione periferica di ossigeno 91% in aria ambiente e la temperatura corporea 38°C. L’emogasanalisi mostrava un’ipossiemia con alcalosi respiratoria (pH 7.53, pO2 59 mmHg, pCO2 27 mmHg, HCO3- 26 mmol/l, lattati 1.7 mmol/l). L’elettrocardiogramma mostrava una tachicardia sinusale alla frequenza cardiaca di circa 100 bpm ed un pattern S1Q3T3.
Agli esami ematochimici si segnalava una leucocitosi neutrofila, troponina ad alta sensibilità 842 ng/L (vn < 14 ng/L), BNP 700 pg/ml (vn < 100 pg/mL), PCT 5 ng/dl, PCR 7 mg/dl, D-dimero 3200 ng/ml, creatinina 1.01 mg/dl.
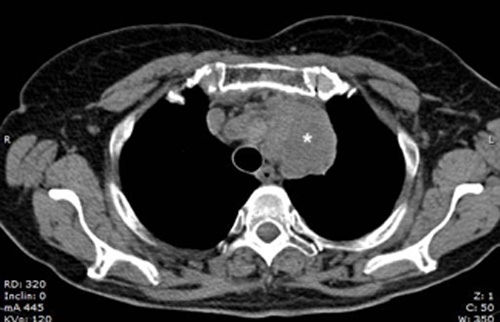
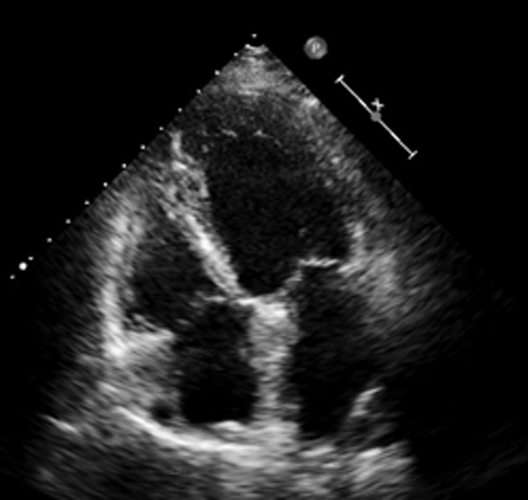
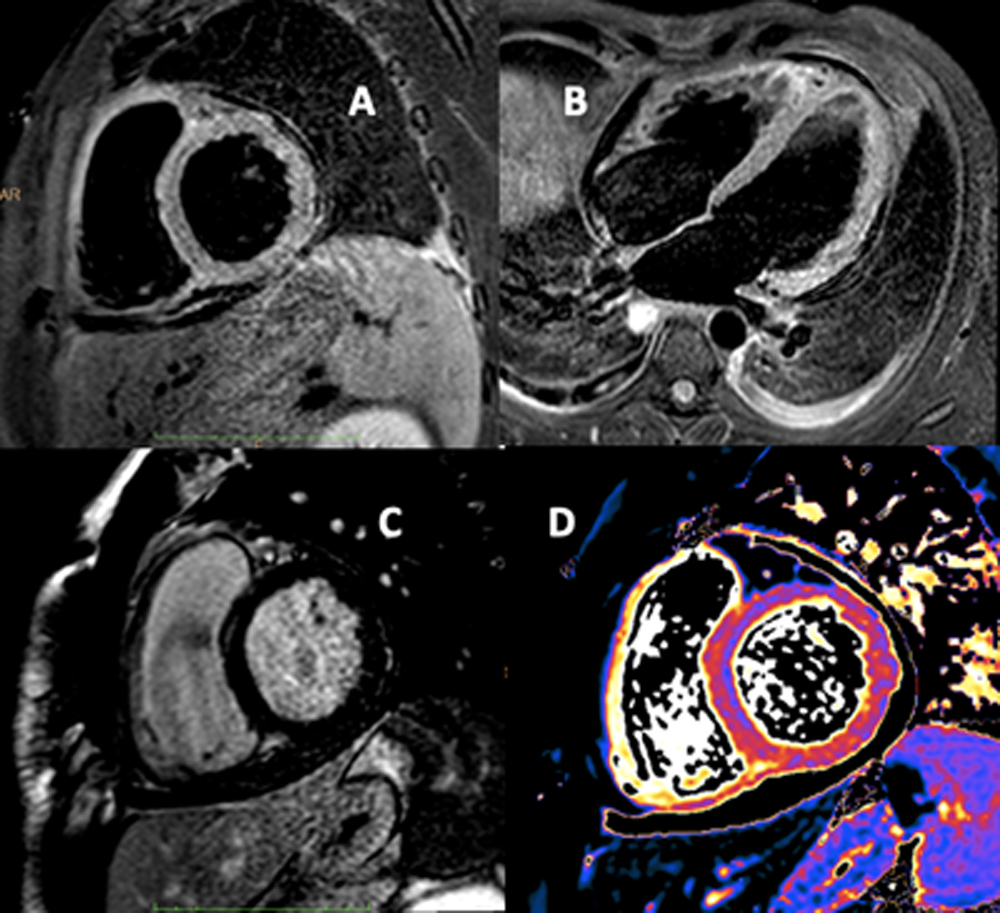
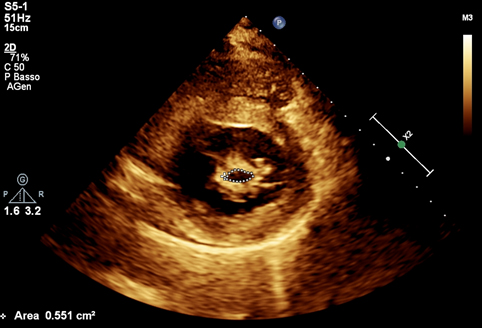
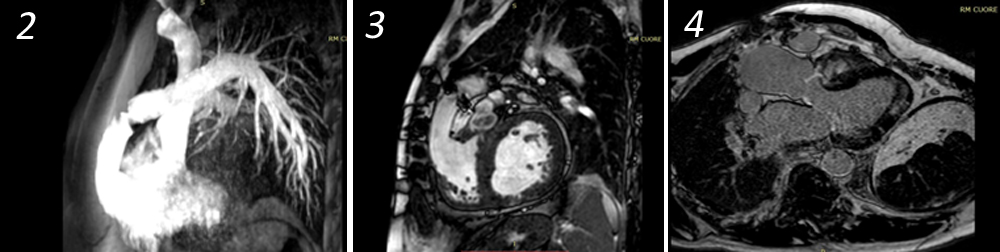
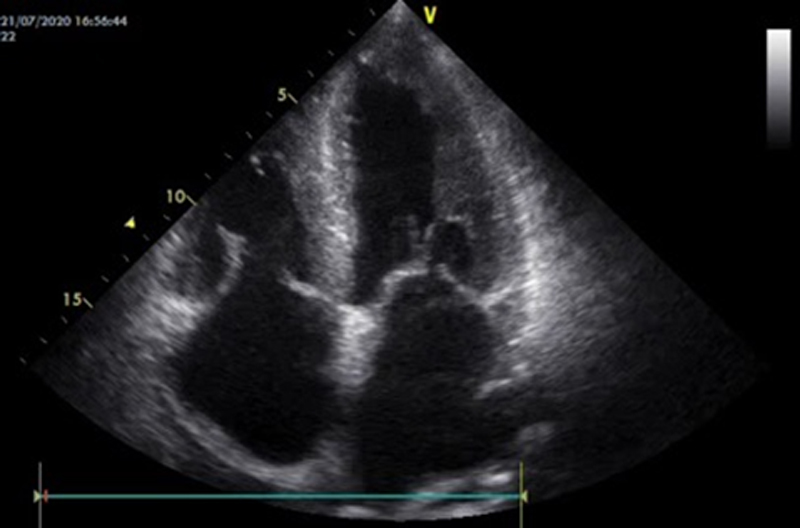
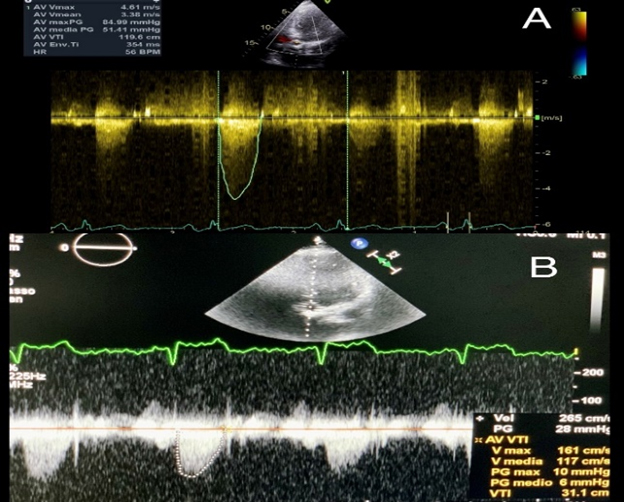
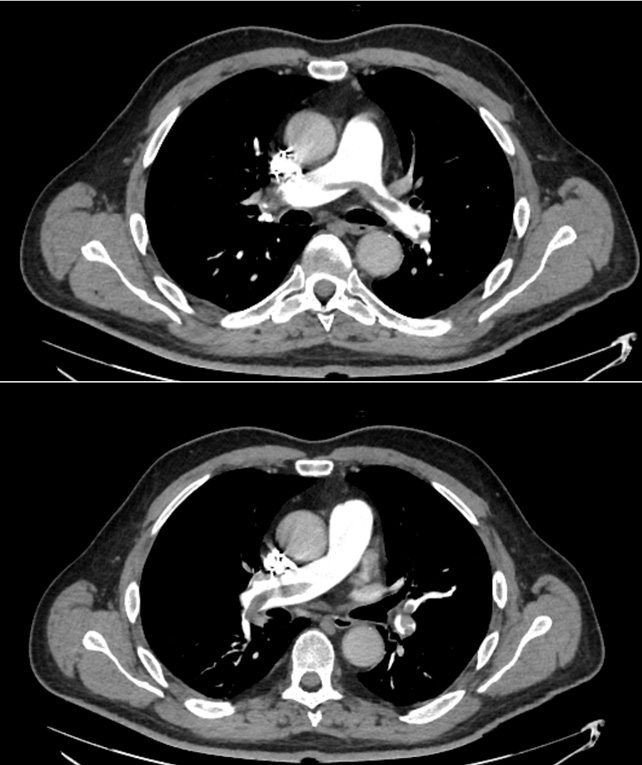
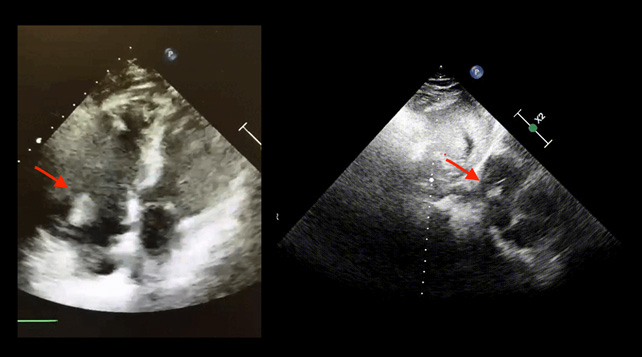
Alla valutazione clinica, la probabilità pre-test di embolia polmonare risultava essere alta (revised Geneva score = 6). Veniva pertanto eseguita un’angio-TC torace con mezzo di contrasto che documentava un’embolia polmonare bilaterale con un trombo a cavaliere (figura 1). Veniva inoltre eseguito un ecocardiogramma che mostrava una buona funzione ventricolare sinistra con un ventricolo destro disfunzionante e dilatato (TAPSE 14 mm, diametro telediastolico medio 48 mm, RV/LV > 1.1) con un’ipocinesia della parete libera e un’ipercinesia dell’apice (segno di McConnell) e un aumento della pressione arteriosa polmonare sistolica stimata (circa 50 mmHg). Venivano inoltre evidenziate delle formazioni trombotiche flottanti nelle sezioni destre (figura 2).
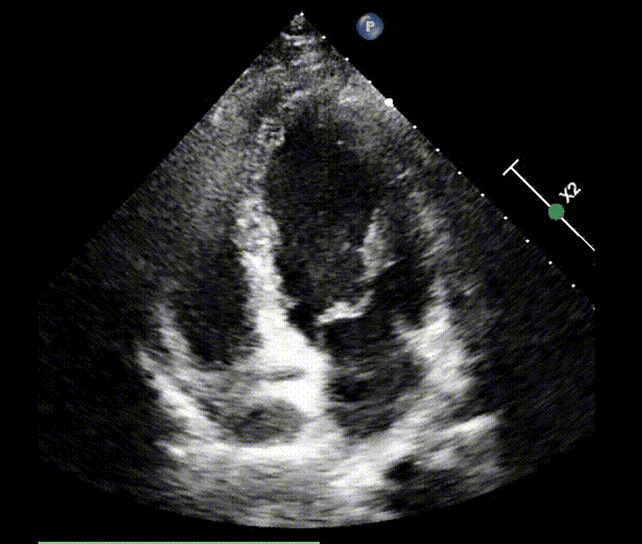
Secondo le linee guida della Società Europea di Cardiologia si poneva diagnosi di embolia polmonare ad intermedio-alto rischio e il paziente veniva ricoverato presso la nostra UTIC. Per la presenza di trombi in transito si eseguiva una trombolisi sistemica con bolo di eparina non frazionata 5000 U.I e Alteplase 100 mg endovena in circa 2 ore. Si impostava, quindi, una terapia con eparina non frazionata in infusione continua mantenendo un valore di aPTT > 2.5 volte i valori normali. Veniva inoltre somministrata ossigenoterapia ed antibioticoterapia empirica con ciprofloxacina nel sospetto di una pielonefrite. L’ecocardiogramma di controllo eseguito a 6 ore mostrava la scomparsa delle formazioni trombotiche nelle sezioni destre, la riduzione della PAPs e del diametro del ventricolo destro con un recupero della funzione sistolica dello stesso (figura 3).
Si assisteva inoltre ad un miglioramento della sintomatologia clinica del paziente. Il giorno successivo si eseguiva un ecocolordoppler degli arti inferiori risultato negativo per trombosi venosa profonda ed una TC dell’addome con mezzo di contrasto che mostrava una pielonefrite acuta sinistra. Dopo 72 ore di terapia con eparina non frazionata si effettuava uno switch ad Edoxaban 60 mg 1 cp/die. Durante la restante degenza si assisteva ad un progressivo miglioramento del quadro clinico e strumentale con una completa risoluzione del quadro settico. Il paziente veniva quindi dimesso con una terapia anticoagulante orale con Edoxaban 60 mg 1 cp/die per 3 mesi.
Discussione
L’embolia polmonare a rischio intermedio-alto rappresenta una condizione clinica eterogena ed ampia. Le linee guida europee sull’embolia polmonare non raccomandano l’utilizzo di una fibrinolisi sistemica routinaria in questo gruppo di pazienti [1]. Dalla letteratura disponibile, riteniamo tuttavia che in alcuni casi sia opportuno ricorrere alla fibrinolisi sin da subito. I fattori che possono spingere ad effettuare un trattamento fibrinolitico sono un alto carico trombotico e un basso rischio emorragico. La presenza di trombi nelle sezioni destre nei pazienti affetti da embolia polmonare è un fattore in grado di peggiorare la sopravvivenza a 30 giorni; ma il trattamento precoce con terapia fibrinolitica conferisce una sopravvivenza a 30 giorni pari a coloro che non presentano trombi nelle sezioni destre [2].
Il trial PEITHO ha mostrato come i pazienti affetti da embolia polmonare a rischio intermedio-alto trattati con fibrinolisi sistemica avevano, a fronte di un aumentato rischio di sanguinamento (OR 5.55 [2.3–13.39]), una riduzione dell’outcome composito di mortalità e successiva instabilità emodinamica rispetto a coloro che venivano trattati con eparina non frazionata (OR 0.44 [CI 0.23–0.87]) (dato guidato soprattutto dall’instabilità emodinamica più che dalla mortalità). Analizzando i sottogruppi dello studio, i pazienti di età inferiore a 75 anni, soprattutto se maschi, avevano meno sanguinamenti maggiori rispetto a quelli di età superiore a 75 anni, soprattutto se donne [2].
L’embolia polmonare del paziente da noi presentato, nonostante la presenza di voluminose formazioni trombotiche altamente instabili nelle sezioni destre e di un trombo a cavaliere, è definita dalla società europea di cardiologia a rischio intermedio-alto. Le linee guida europee non considerano la presenza di trombi nelle sezioni destre come elemento in grado di modificare il rischio dell’embolia polmonare e pertanto non raccomandano l’utilizzo routinario di una fibrinolisi sistemica in questa tipologia di paziente[1]. Al contrario, le società scientifiche americane stabiliscono che la presenza di trombi nelle cavità cardiache sia un elemento sufficiente per definire un’embolia ad alto rischio e quindi necessitante di trattamento fibrinolitico [4].
Riteniamo quindi che la scelta della strategia terapeutica da intraprendere nei pazienti con embolia polmonare ad intermedio-alto rischio vada personalizzata alla luce del burden trombotico ed emorragico del singolo paziente, per individuare in maniera migliore quelli che potrebbero beneficiare sin da subito di una terapia fibrinolitica.
Bibliografia
- Konstantinides SV, Meyer G, Becattini C, Bueno H, Geersing GJ, Harjola VP, Huisman MV, Humbert M, Jennings CS, Jiménez D, Kucher N, Lang IM, Lankeit M, Lorusso R, Mazzolai L, Meneveau N, Ní Áinle F, Prandoni P, Pruszczyk P, Righini M, Torbicki A, Van Belle E, Zamorano JL; ESC Scientific Document Group. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J. 2020 Jan 21;41(4):543-603. doi: 10.1093/eurheartj/ehz405. PMID: 31504429.
- Barrios D, Rosa-Salazar V, Jiménez D, Morillo R, Muriel A, Del Toro J, López-Jiménez L, Farge-Bancel D, Yusen R, Monreal M; RIETE investigators. Right heart thrombi in pulmonary embolism. Eur Respir J. 2016 Nov;48(5):1377-1385.
- Meyer G, Vicaut E, Danays T, Agnelli G, Becattini C, Beyer-Westendorf J, Bluhmki E, Bouvaist H, Brenner B, Couturaud F, Dellas C, Empen K, Franca A, Galiè N, Geibel A, Goldhaber SZ, Jimenez D, Kozak M, Kupatt C, Kucher N, Lang IM, Lankeit M, Meneveau N, Pacouret G, Palazzini M, Petris A, Pruszczyk P, Rugolotto M, Salvi A, Schellong S, Sebbane M, Sobkowicz B, Stefanovic BS, Thiele H, Torbicki A, Verschuren F, Konstantinides SV; PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014 Apr 10;370(15):1402-11.
- Alejandra Gutierrez Bernal, MD; Christina Fanola, MD; Jason Alan Bartos, MD, PhD, FACC; Management of pulmonary embolism. Disponibile su https://www.acc.org/latest-in-cardiology/articles/2020/01/27/07/42/management-of-pe