Nicolina Conti, Mattia Garofalo
Alma Mater Studiorum – Università di Bologna, Dipartimento di Medicina Specialistica, Diagnostica e Sperimentale
IRCCS Policlinico Sant’Orsola-Malpighi, Bologna
ABSTRACT
I dati anamnestici di diatesi allergica e pregressa gastroenterite eosinofila e l’evidenza clinico-strumentale di rash cutaneo, dolore toracico atipico con versamento pericardico, scompenso cardiaco acuto con severa disfunzione sistolica biventricolare di nuova insorgenza in assenza di dilatazione e danno miocardico acuto hanno portato alla diagnosi biopsy-proven di perimiocardite acuta eosinofila da ipersensibilità ad Amoxicillina/Clavulanato in un giovane adulto ricoverato per sepsi addominale con improvvisa insorgenza di astenia, dispnea e dolore precordiale in stato di pre-shock cardiogeno.
CASO CLINICO
Presentiamo il caso clinico di un paziente uomo, di 26 anni, fumatore, in assenza di ulteriori fattori di rischio cardiovascolare e precedenti cardiologici di rilievo. In anamnesi: asma allergico stagionale, quiescente dall’adolescenza; pregressa gastroenterite eosinofila in poliallergia alimentare; recente infezione paucisintomatica da SARS-CoV-2.
Da qualche giorno il paziente lamentava febbre con brivido (TC massima 39°C) associata a dolore addominale ed alvo alterno, per cui aveva intrapresoantibioticoterapia empirica con Amoxicillina-Clavulanato. Per il persistere della sintomatologia, il paziente accedeva in Pronto Soccorso e veniva ricoverato presso il reparto di Medicina Interna in considerazione del quadro clinico-laboratoristico di sepsi addominale (rialzo della proteina C reattiva, della procalcitonina e della conta totale dei globuli bianchi con neutrofilia e linfopenia ed eosinofili nei limiti della norma). Il quadro clinico generale appariva stabile, con parametri vitali regolari salvo il rialzo termico, buon compenso cardiocircolatorio, tracciato elettrocardiografico (ECG) nei limiti ed indici epatorenali in range.
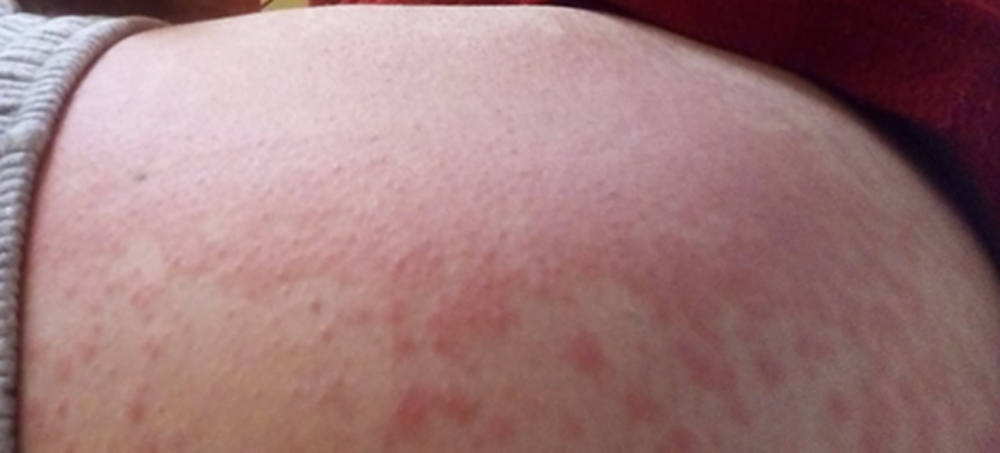
Si assisteva tuttavia al graduale peggioramento di un rash eritematoso pruriginoso, a partenza dalla radice degli arti inferiori e poi irradiatosi alla regione lombo-sacrale [Fig. 1], insorto al domicilio dopo le prime assunzioni di Amoxicillina-Clavulanato. Nel sospetto di ipersensibilità a tale principio attivo si procedeva quindi alla sostituzione dello stesso con Ciprofloxacina e Metronidazolo.
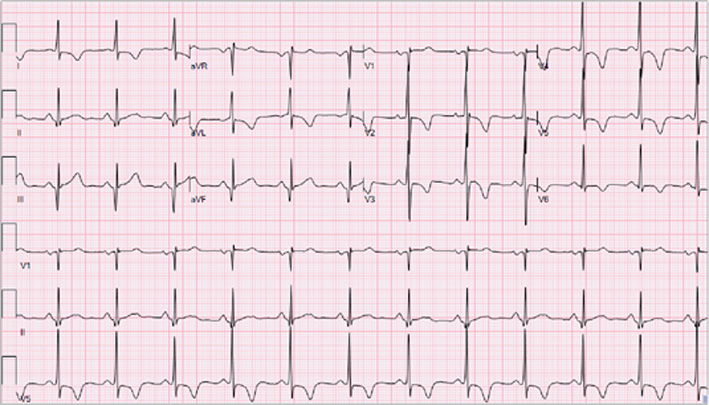
Nel corso del ricovero si verificava l’improvvisa insorgenza di astenia, dispnea e dolore toracico atipico (urente, modificabile con gli atti respiratori ed il decubito, non correlato allo sforzo), con solo un’aspecifica inversione dell’onda T in aVL e V2 all’ECG ma evidenza di danno miocardico acuto agli esami ematochimici (hs-cTnI 470 > 300 > 900 ng/L, v.n. < 19.8), per cui il paziente veniva trasferito presso l’Unità di Terapia Intensiva Cardiologica (UTIC).
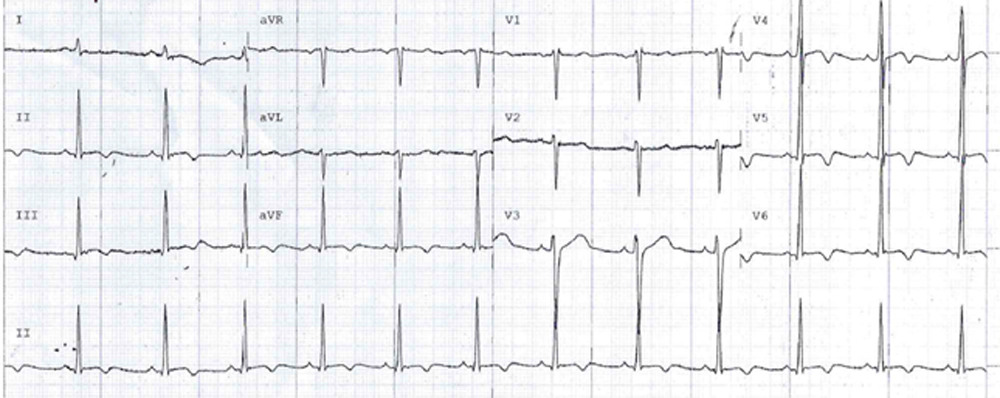
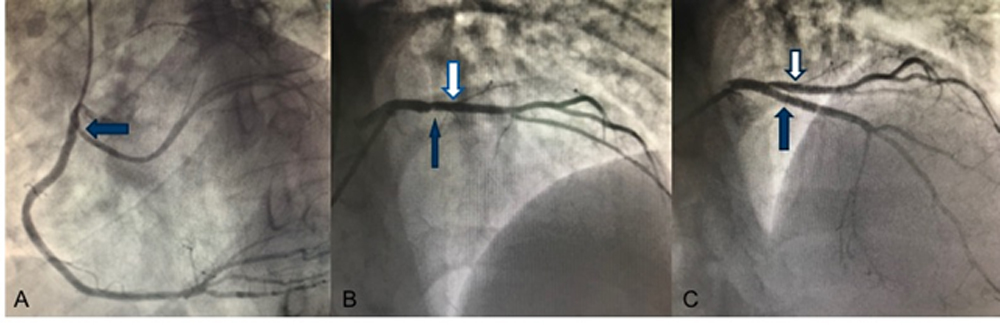
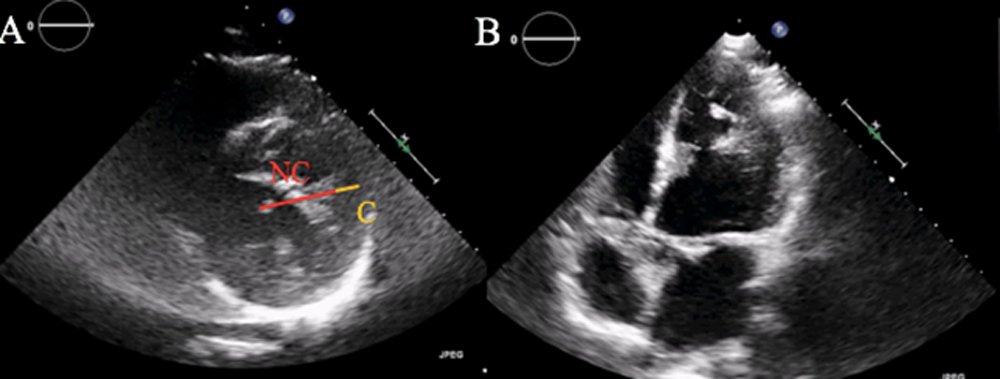
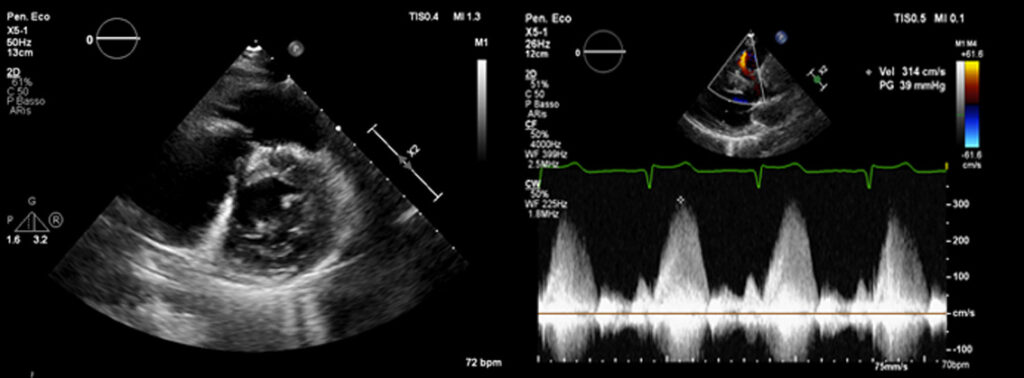
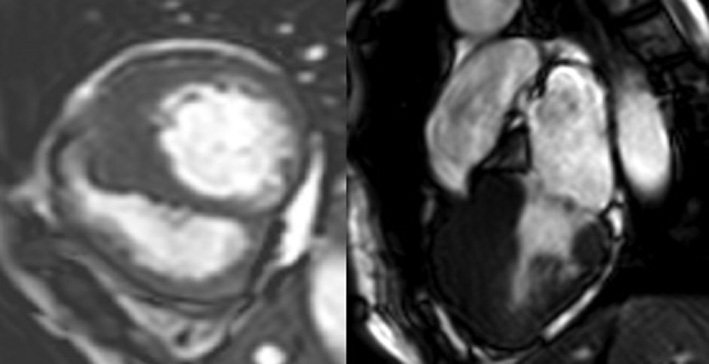
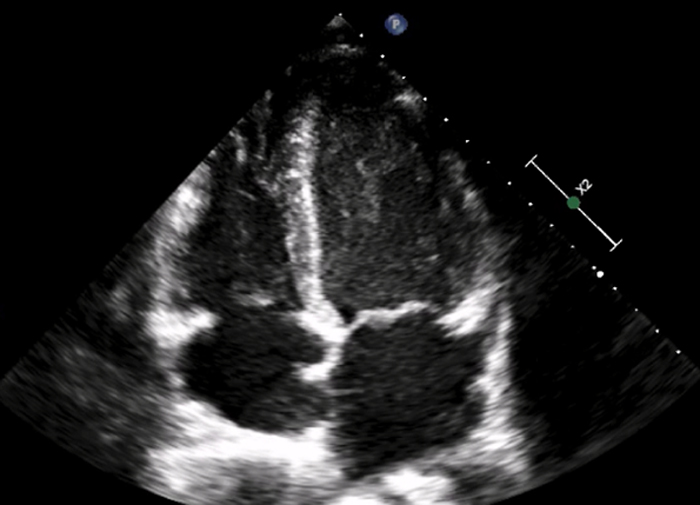
La valutazione in UTIC evidenziava pressione arteriosa (PA) 90/60 mmHg (drop pari a 40 mmHg dall’ingresso), frequenza cardiaca (FC) 98 bpm, SpO2 96% in aria ambiente, sensorio integro, arti ben perfusi, diuresi oraria 35 cc/h e lattati 1.3 mmol/L, mentre gli ECG seriati mostravano lo sviluppo di onde T piatte/negative in sede inferiore, anteriore e laterale [Fig. 2]. L’ecocardiogramma rilevava una severa disfunzione sistolica biventricolare (FEVS 25%, TAPSE 12 mm) con effetto smoke in ventricolo sinistro [Fig. 3], flusso rallentato in vena cava inferiore ed un minimo versamento pericardico, in assenza di dilatazione delle camere cardiache, valvulopatie di rilievo o segni di ipertensione polmonare.
Nell’ipotesi di perimiocardite acuta in fase di pre-shock cardiogeno veniva pertanto impostata terapia con corticosteroide ad alto dosaggio per via endovenosa, diuretico ed ACE-inibitore, con netto beneficio clinico, sia sintomatologico che emodinamico, nell’arco delle 12 ore successive, come evidenziato al cateterismo cardiaco destro documentante normali pressioni di riempimento biventricolari (PAD 7 mmHg, PCP 12 mmHg) in assenza di ipertensione polmonare (PAPm 16 mmHg) ma con indice cardiaco solo ai limiti superiori (4.2 L/min) a fronte di resistenze vascolari sistemiche ai limiti inferiori (10 uW), nel contesto della nota sepsi.
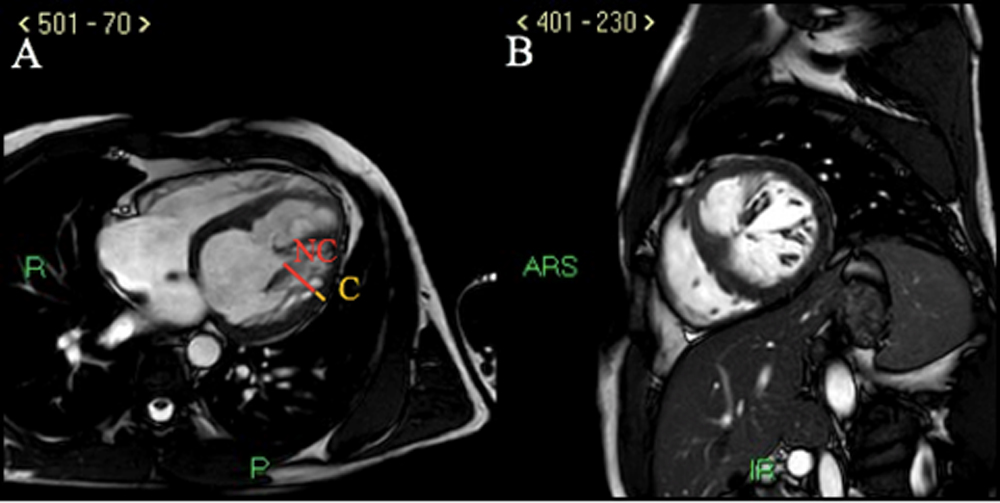
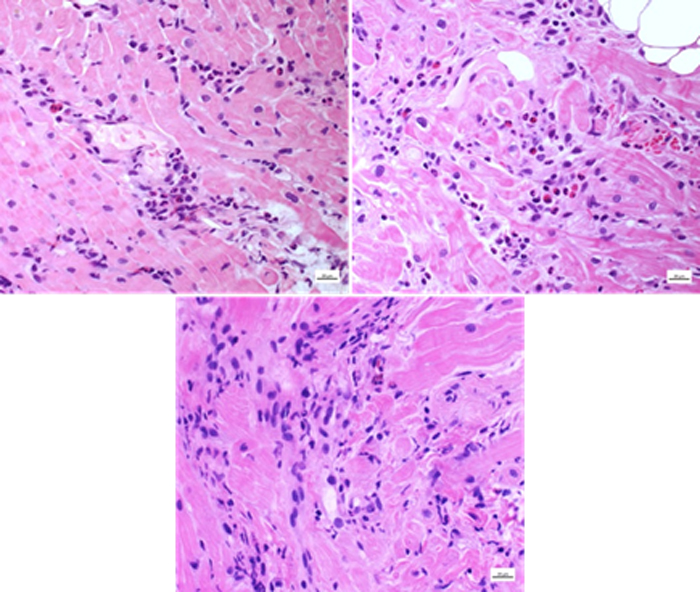
Veniva eseguita contestualmente una biopsia endomiocardica [Fig. 4] con riscontro di miocardite (infiltrati infiammatori, edema, fibrosi e danno miocellulare) eosinofila con pattern suggestivo di eziologia da ipersensibilità. Gli esami autoimmunitari e microbiologici condotti su siero e feci risultavano invece negativi.
In considerazione dell’anamnesi patologica remota (diatesi allergica, pregressa gastroenterite eosinofila), del quadro clinico-strumentale (rash cutaneo, danno miocardico acuto, scompenso cardiaco acuto con disfunzione sistolica biventricolare in assenza di dilatazione, dolore toracico pericarditico con minimo versamento pericardico) e del riscontro bioptico veniva quindi posta diagnosi di perimiocardite acuta eosinofila da ipersensibilità ad Amoxicillina/Clavulanato.
Veniva pertanto confermata la sospensione del farmaco trigger e proseguita terapia corticosteroidea per os e con ACE-inibitore. L’evoluzione clinica si dimostrava favorevole, sia in termini clinici (asintomaticità, stabilità emodinamica ed elettrica, risoluzione del quadro settico) che alla risonanza magnetica nucleare (RMN) cardiaca eseguita dopo una settimana (miglioramento FEVS sino a 50%, assenza di edema o fibrosi).
DISCUSSIONE
Il caso clinico è relativo ad una perimiocardite acuta eosinofila da ipersensibilità ad esordio con scompenso cardiaco acuto in un giovane paziente.
In considerazione dell’età, della bassa probabilità di coronaropatia (assenza di fattori di rischio, atipicità del dolore toracico, ECG non suggestivo), della severa disfunzione contrattile biventricolare in assenza di dilatazione (a favore di un processo acuto piuttosto che subacuto/cronico) e del contesto infettivo e allergico, l’orientamento diagnostico iniziale del danno miocardico acuto è stato indirizzato verso una sospetta perimiocardite acuta. Inoltre, in considerazione dell’eziologia non nota, del dato anamnestico di eosinofilia tissutale e della relativa instabilità emodinamica (stadio SCAI – Society for Cardiac Angiography and Interventions – tipo B (1), ovvero pre-shock cardiogeno) con alto rischio evolutivo, è stata eseguita una biopsia endomiocardica (2) che ha permesso di porre una diagnosi di certezza e di proseguire con il relativo trattamento.
L’eziologia (3) della miocardite eosinofila può essere idiopatica (circa 30% dei casi) o è da riferirsi ad una sindrome ipereosinofila, a malattie sistemiche immuno-mediate quali la granulomatosi eosinofila con poliangioite, ad infezioni parassitarie (e non solo), a neoplasie solide o ematologiche oppure, in circa un terzo dei casi, ad una reazione da ipersensibilità; in particolare, tra i farmaci più frequentemente responsabili troviamo antibiotici, antinfiammatori, farmaci neuroattivi, diuretici, ACE-inibitori ed inotropi (4; 5). Nelle forme da ipersensibilità il quadro può rientrare nel contesto della sindrome di DRESS (Drug Rash with Eosinophilia and Systemic Symptoms), forma severa di reazione allergica a coinvolgimento multisistemico ed esordio ritardato di qualche settimana rispetto all’esposizione (6).
La presentazione clinica della miocardite eosinofila acuta è variabile, dalla completa asintomaticità ad una pseudo-sindrome coronarica acuta o episodio di scompenso cardiaco acuto, con o senza instabilità elettrica, la quale può anche di per sé rappresentare l’esordio della patologia (3); il decorso può anche essere fulminante. Inoltre, alla fase acuta necrotico-infiammatoria può seguire una fase cronica fibrotica e trombotica, con fenotipo restrittivo ed eventuale formazione di trombi endoventricolari, a cui ci si riferisce con il termine di endocardite/cardiomiopatia di Loeffler (7). L’eosinofilia periferica è molto comune (75%) ma non mandatoria per la diagnosi, in particolare si rileva meno spesso nelle forme da ipersensibilità (8). Una peculiarità riguarda la distribuzione alla RMN cardiaca del ritardato wash-out di gadolinio, più comunemente patchy ma a localizzazione subendocardica (9; 10). Un altro dato interessante riguarda la prognosi tra i vari sottotipi (3): l’outcome peggiore si osserva nei casi ad eziologia da ipersensibilità, con una mortalità a 120 giorni pari a circa il 50%, verosimilmente a causa dell’assenza di ipereosinofilia periferica e del conseguente ritardo diagnostico; d’altro canto, una volta posta la diagnosi, sospeso il trigger ed impostata la terapia immunosoppressiva, la prognosi migliora drasticamente (7).
Bibliografia
1. Baran DA, Grines CL, Bailey S, Burkhoff D, Hall SA, Henry TD, Hollenberg SM, Kapur NK, O’Neill W, Ornato JP, Stelling K, Thiele H, van Diepen S, Naidu SS. SCAI clinical expert consensus statement on the classification of cardiogenic shock. Catheter Cardiovasc Interv. 2019, Jul 1;94(1):29-37.
2. Cipriani M, Merlo M, Gabrielli D, Ammirati E, Autore C, Basso C, Caforio A, Caldarola P, Camici P, Di Lenarda A, Frustaci A, Imazio M, Oliva F, Pedrotti P, Perazzolo Marra M, Rapezzi C, Urbinati S, Zecchin M, Filardi PP, Colivicchi F, Indolfi C, et al. Documento di consenso ANMCO/SIC sulla gestione delle miocarditi. G Ital Cardiol. 2020, Dec;21(12):969-989.
3. Brambatti M, Matassini MV, Adler ED, Klingel K, Camici PG, Ammirati E. Eosinophilic Myocarditis: Characteristics, Treatment, and Outcomes. J Am Coll Cardiol. 2017, Nov 7;70(19):2363-2375.
4. Taliercio CP, Olney BA, Lie JT. Myocarditis related to drug hypersensitivity. Mayo Clin Proc. 1985, Jul;60(7):463-8.
5. Takkenberg JJ, Czer LS, Fishbein MC, Luthringer DJ, Quartel AW, Mirocha J, Queral CA, Blanche C, Trento A. Eosinophilic myocarditis in patients awaiting heart transplantation. Crit Care Med. 2004, Mar;32(3):714-21.
6. Kardaun SH, Sekula P, Valeyrie-Allanore L, Liss Y, Chu CY, Creamer D, Sidoroff A, Naldi L, Mockenhaupt M, Roujeau JC. Drug reaction with eosinophilia and systemic symptoms (DRESS): an original multisystem adverse drug reaction. Results from the prospective RegiSCAR study. Br J Dermatol. 2013, Nov;169(5):1071-80. .
7. Ammirati E, Frigerio M, Adler ED, Basso C, Birnie DH, Brambatti M, Friedrich MG, Klingel K, Lehtonen J, Moslehi JJ, Pedrotti P, Rimoldi OE, Schultheiss HP, Tschöpe C, Cooper LT Jr, Camici PG. Management of Acute Myocarditis and Chronic Inflammatory Cardiomyopathy: An Expert Consensus Document. Circ Heart Fail. 2020, Nov;13(11):e007405.
8. Fozing T, Zouri N, Tost A, Breit R, Seeck G, Koch C, Oezbek C. Management of a patient with eosinophilic myocarditis and normal peripheral eosinophil count: case report and literature review. Circ Heart Fail. 2014, Jul;7(4):692-4.
9. Kuchynka P, Palecek T, Masek M, Cerny V, Lambert L, Vitkova I, Linhart A. Current Diagnostic and Therapeutic Aspects of Eosinophilic Myocarditis. Biomed Res Int. 2016, 2016:2829583.
10. Satoh H, Sano M, Suwa K, Saitoh T, Nobuhara M, Saotome M, Urushida T, Katoh H, Hayashi H. Distribution of late gadolinium enhancement in various types of cardiomyopathies: Significance in differential diagnosis, clinical features and prognosis. World J Cardiol. 2014, Jul 26;6(7):585-601.