Rodolfo Francesco Massafra, Matteo Bertini, Francesco Vitali, Michele Malagù, Claudio Rapezzi
Centro Cardiologico Universitario, Università degli Studi di Ferrara, Arcispedale S. Anna, Ferrara
Abstract
Di seguito viene illustrato il caso di un paziente con malattia critica COVID-19 in cui la comparsa improvvisa di flutter atriale ad elevata risposta ventricolare ha giocato un ruolo determinante nel peggioramento dell’insufficienza respiratoria, e in cui dopo alcuni tentativi di controllo farmacologico del ritmo e della frequenza, una strategia di controllo del ritmo mediante ablazione transcatetere ha portato a un decisivo miglioramento del quadro clinico. Il caso evidenzia come la patologia COVID-19 abbia un impatto notevole sul sistema cardiovascolare anche per la possibile insorgenza di aritmie che possono aggravare il compenso cardio-respiratorio, creando un circolo vizioso.
Caso clinico
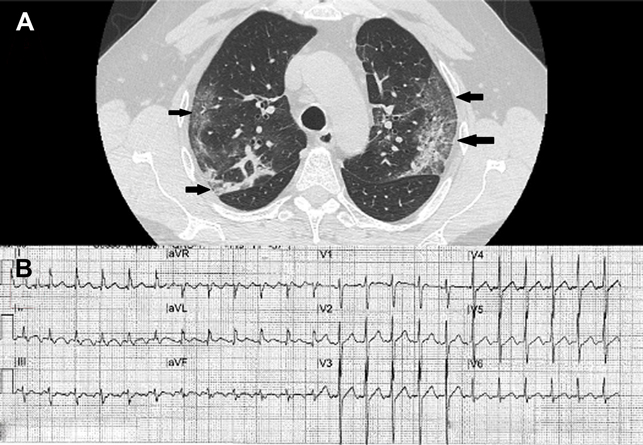
Un uomo di 61 anni, senza nessun precedente cardiovascolare noto né fattori di rischio cardiovascolari o comorbidità di rilievo, giungeva in PS per dispnea, tosse e febbre (39°C). Normoteso (PA 120/60 mmHg), tachipnoico (33 atti/minuto) e con SpO2 89%. Per il rapido peggioramento dell’insufficienza respiratoria veniva intubato. Alla HRCT emergeva un quadro di severa polmonite interstiziale bilaterale con aspetto “crazy paving” (Fig. 1A). Ricoverato in ambiente intensivo, l’ECG all’ingresso mostrava tachicardia sinusale a FC 100 bpm. Seguiva riscontro di positività del tampone nasofaringeo RT-PCR per RNA di SARS-CoV2. In nona giornata, per il miglioramento del quadro respiratorio, il paziente veniva estubato e posto in NIV con casco. Nella giornata successiva si assisteva a riacutizzazione di insufficienza respiratoria con evidenza al monitor ECG di flutter atriale tipico comune ad elevata risposta ventricolare (Fig. 1B).
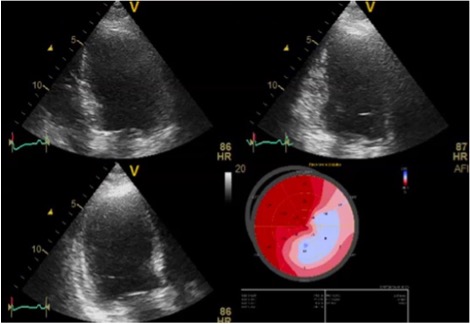
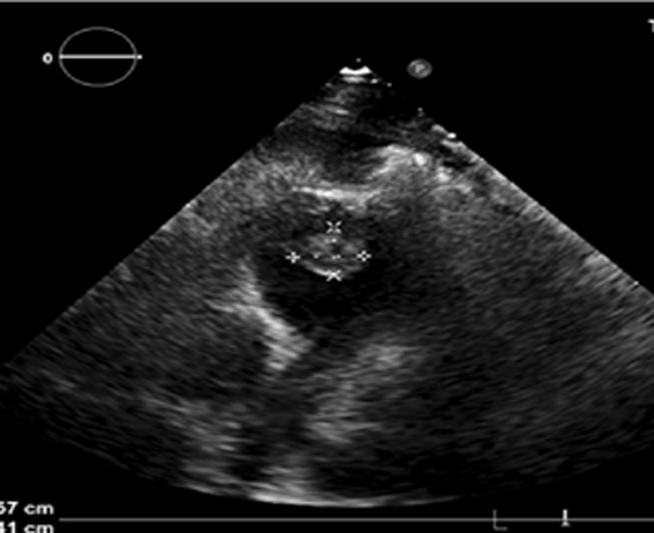
Veniva eseguito ecocardiogramma transtoracico, che mostrava ventricolo sinistro con funzione sistolica ai limiti di norma (FE 50%), segni di aumento delle pressioni di riempimento (E/e’ media 16) e lieve dilatazione atriale destra. Alla luce della disfunzione diastolica e del mancato contributo atriale al riempimento ventricolare, ritenuta la correzione di tali elementi in grado di migliorare il compenso cardio-respiratorio, si decideva di attuare una strategia di controllo del ritmo. Visto il riscontro laboratoristico di alterazione degli indici di funzionalità epatica in contestuale verosimile sovrainfezione batterica, si decideva di eseguire tentativo di cardioversione elettrica esterna (CVE) a 120J, come da indicazioni ESC nel paziente emodinamicamente stabile (Classe I, LoE B) quale valida alternativa in prima istanza al controllo farmacologico della frequenza o del ritmo.1 La CVE esitava in transitorio ripristino di ritmo sinusale, ma pressoché immediata ricomparsa dell’aritmia. Seguiva nuovo tentativo di CVE a 150J in corso di amiodarone in infusione, con ripristino del ritmo sinusale, ma nuova recidiva dell’aritmia a distanza di ore. Fallito il controllo del ritmo, si optava per controllo della frequenza mediante infusione di metoprololo, verapamil e digossina a dosaggio pieno, (Classe IIa, LoE B) senza però alcun beneficio clinico.
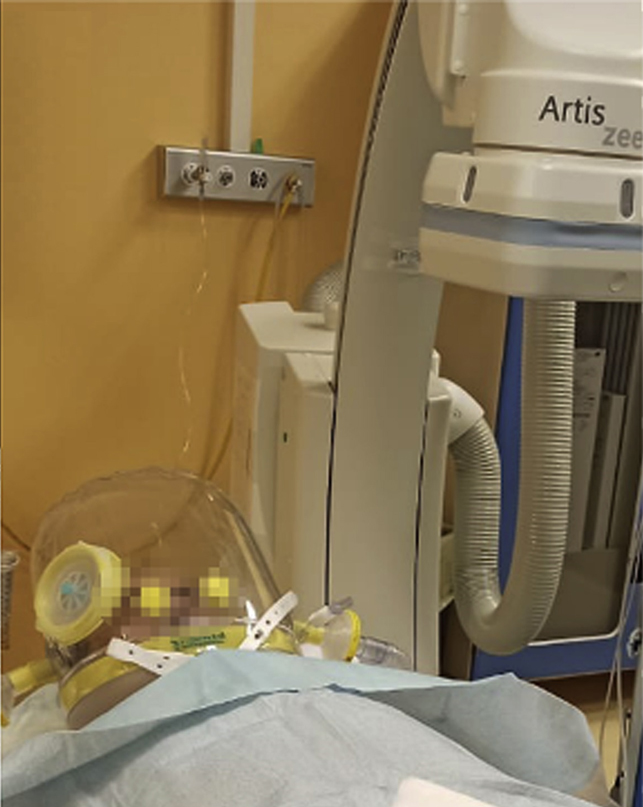
Discusso il caso in team multidisciplinare (cardiologo clinico, elettrofisiologo, rianimatore e pneumologo), si continuava a imputare alla tachiaritmia un ruolo primario nell’alterazione del compenso cardio-respiratorio, perciò, ancora una volta si riteneva opportuno intraprendere strategia di controllo del ritmo. Inoltre, data la gravità del quadro clinico e la refrattarietà dell’aritmia a tutte le strategie terapeutiche disponibili indicate dalle linee guida ESC nello specifico setting acuto,1 si decideva per esecuzione di ablazione transcatetere con assistenza anestesiologica. In considerazione della presenza di ventilazione con casco, della conseguente difficoltà nell’utilizzo di fluoroscopia, e data l’impossibilità di mantenere a lungo il clinostatismo, si optava per procedura a raggi zero interamente guidata da mappaggio elettroanatomico tridimensionale, riducendo al minimo i tempi operatori. La procedura si svolgeva in conformità alle raccomandazioni internazionali per garantire la sicurezza del paziente e minimizzare l’esposizione professionale del personale impiegato (un elettrofisiologo senior, due anestesisti e un infermiere specializzato)2.
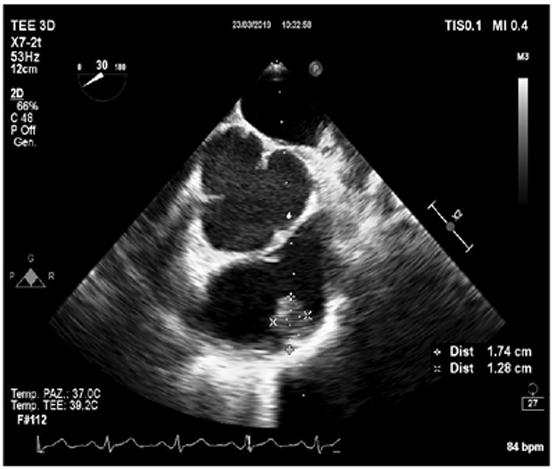
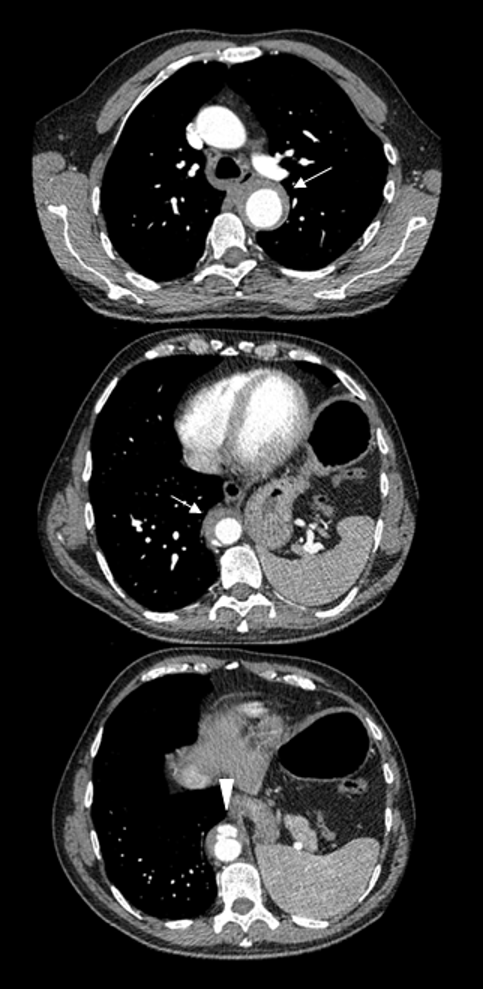
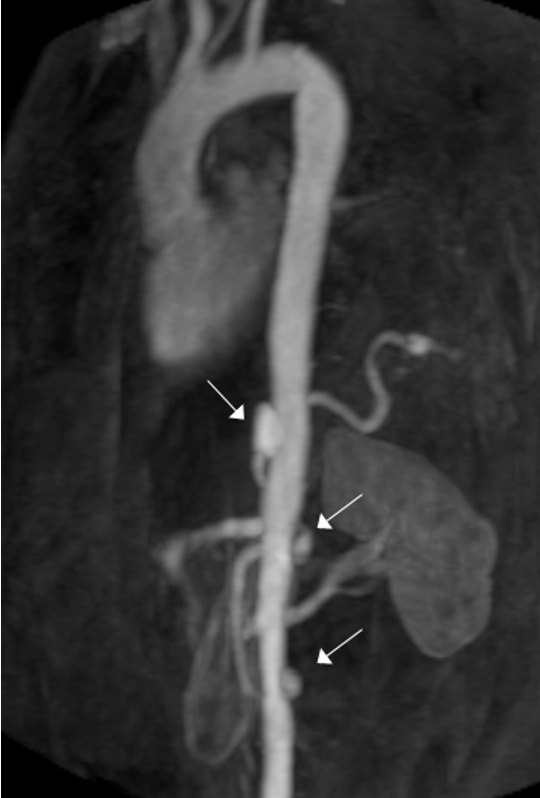
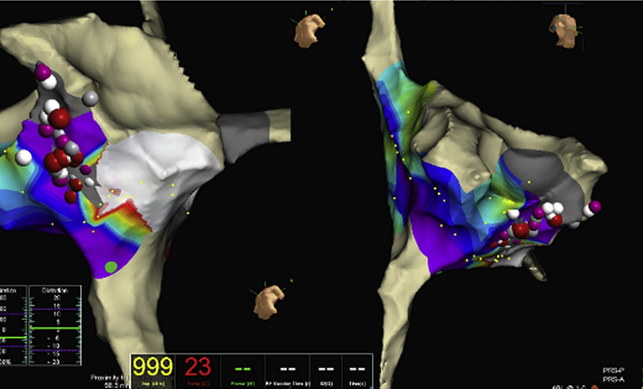
Posto il paziente in clinostatismo, ventilato con casco (Fig. 2), si procedeva a doppia puntura venosa femorale destra. Eseguito mappaggio endocardico, si confermava la presenza di flutter atriale istmo cavo-tricuspidalico dipendente, che veniva efficacemente trattato tramite ablazione mediante radiofrequenza, con ripristino di ritmo sinusale. Alla mappa di attivazione si confermava blocco bidirezionale istmo cavo-tricuspidalico durante stimolazione dall’ostio coronarico.3 (Fig. 3) La durata complessiva della procedura era inferiore a 60 minuti.
Al ripristino del ritmo sinusale il paziente mostrava un notevole e pressoché immediato miglioramento della funzionalità respiratoria, con passaggio della SpO2 dall’84% al 98% e miglioramento soggettivo della dispnea.
Conclusioni
Il caso clinico sottolinea il contributo ormai noto del flutter atriale ad elevata risposta ventricolare al deterioramento respiratorio nel paziente COVID-19,4,5 oltre che il potenziale ruolo terapeutico della strategia di controllo del ritmo mediante ablazione transcatetere, ad oggi largamente inesplorato in questo scenario. Al momento in letteratura non vi sono evidenze di qualità circa l’efficacia della terapia medica finalizzata al controllo del ritmo o della frequenza nel flutter atriale nel paziente critico COVID-19.5 Tuttavia, l’efficacia della terapia medica in questi pazienti è da ritenersi potenzialmente bassa per una serie di ragioni, delle quali la patologia polmonare sottostante e lo stato infiammatorio sistemico assumono probabilmente un ruolo fondamentale, agendo da fattori scatenanti.4 Inoltre, l’utilizzo di amiodarone per il controllo del ritmo potrebbe esporre a severi effetti avversi pneumotossici da citotossicità diretta e da ipersensibilità, particolarmente problematici in questo genere di paziente. L’ablazione transcatetere è una procedura relativamente semplice, ed è il trattamento più efficace per il mantenimento del ritmo sinusale nel flutter atriale.3,6 Essa si mostra potenzialmente utile anche in alcuni scenari critici di insufficienza respiratoria acuta con severa pneumopatia sottostante, in cui diventa decisivo ristabilire un adeguato compenso cardiocircolatorio, qualora l’aritmia risulti refrattaria alle strategie terapeutiche attualmente indicate dalle linee guida.
References
1. Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomström-Lundqvist C, Calkins H, Corrado D, Deftereos SG, Diller GP, Gomez-Doblas JJ, Gorenek B, Grace A, Ho SY, Kaski JC, Kuck KH, Lambiase PD, Sacher F, Sarquella-Brugada G, Suwalski P, Zaza A; ESC Scientific Document Group. 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J. 2020 Feb 1;41(5):655-720. doi: 10.1093/eurheartj/ehz467. Erratum in: Eur Heart J. 2020 Nov 21;41(44):4258. PMID: 31504425.
2. Lakkireddy DR, Chung MK, Gopinathannair R, et al. Guidance for Cardiac Electrophysiology During the COVID-19 Pandemic from the Heart Rhythm Society COVID-19 Task Force; Electrophysiology Section of the American College of Cardiology; and the Electrocardiography and Arrhythmias Committee of the Council on Clinical Cardiology, American Heart Association. Circulation 2020;141: e823–31
3. Shah DC, Jaïs P, Haïssaguerre M, et al. Three-dimensional mapping of the common atrial flutter circuit in the right atrium. Circulation.1997; 96:3904–3912.
4. Peltzer B, Manocha KK, Ying X, Kirzner J, Ip JE, Thomas G, Liu CF, Markowitz SM, Lerman BB, Safford MM, Goyal P, Cheung JW. Outcomes and mortality associated with atrial arrhythmias among patients hospitalized with COVID-19. J Cardiovasc Electrophysiol. 2020 Dec;31(12):3077-3085. doi: 10.1111/jce.14770. Epub 2020 Oct 14. PMID: 33017083; PMCID: PMC7675597.
5. Colon, C. M., Barrios, J. G., Chiles, J. W., McElwee, S. K., Russell, D. W., Maddox, W. R., & Kay, G. N. (2020). Atrial Arrhythmias in COVID-19 Patients. JACC: Clinical Electrophysiology. doi:10.1016/j.jacep.2020.05.015
6. Natale A, Newby KH, Pisanó E, Leonelli F, Fanelli R, Potenza D, Beheiry S, Tomassoni G. Prospective randomized comparison of antiarrhythmic therapy versus first-line radiofrequency ablation in patients with atrial flutter. J Am Coll Cardiol. 2000 Jun;35(7):1898-904. doi: 10.1016/s0735-1097(00)00635-5. PMID: 10841241.

![Abstract grafico commento MINOCA[1] - Sola lettura](https://www.italiancot.it/wp-content/uploads/2021/04/Abstract-grafico-commento-MINOCA1-Sola-lettura-1300x731.jpg)