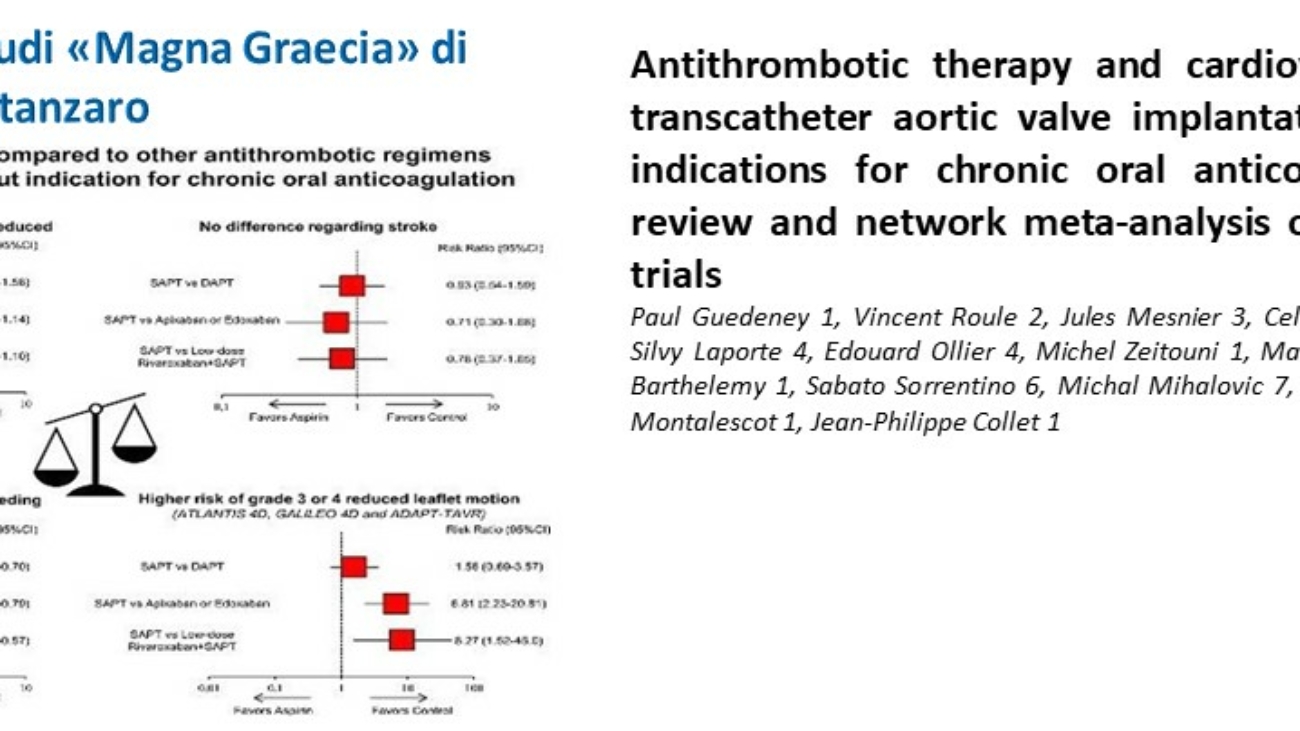
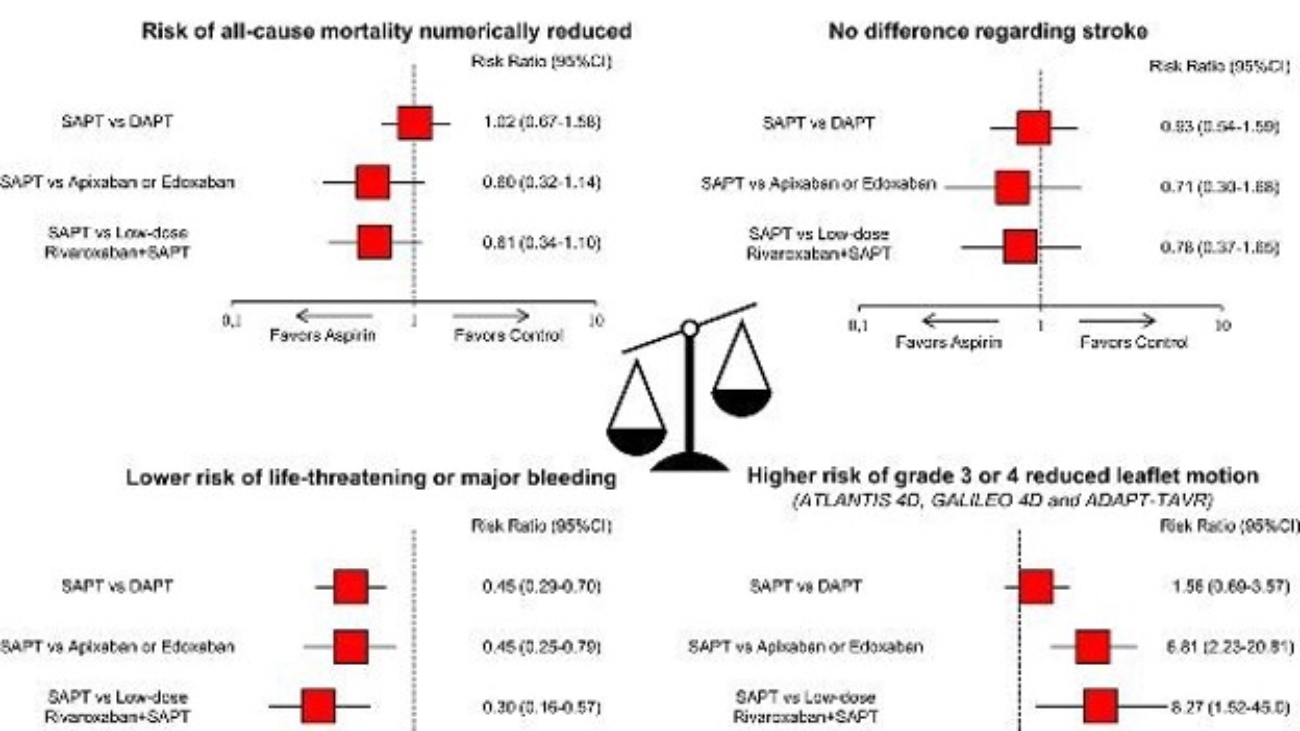
Laura Torlai Triglia1, Luigi Gerra1, Rachele Bertolini1, Marco Stuani1, Giulia Gorlato1, Giuseppe Boriani1
1Università degli Studi di Modena e Reggio Emilia
ABSTRACT
La prevalenza dell’embolia polmonare nel paziente oncologico è elevata, con un rischio che arriva fino al 20% nel primo anno dopo la diagnosi, a seconda del tipo di neoplasia[1]. Il tromboembolismo venoso rappresenta la seconda causa di morte nei pazienti con neoplasie a causa dei numerosi fattori di rischio trombotico[2]. L’embolia polmonare ad alto rischio nel
paziente con neoplasie cerebrali primitive o secondarie rappresenta una sfida terapeutica dato l’elevato rischio emorragico e la controindicazione assoluta alla fibrinolisi. Il trattamento percutaneo rappresenta una valida alternativa in caso di controindicazione o fallimento della terapia standard in centri con esperienza[3].
CASO CLINICO
Presentiamo il caso di un uomo di 65 anni, senza precedenti cardiologici, affetto da glioma diffuso astrocitario anaplastico recidivante trattato in precedenza con chemio e radioterapia, in evoluzione all’ultimo follow-up oncologico. Il paziente giungeva in Pronto Soccorso per
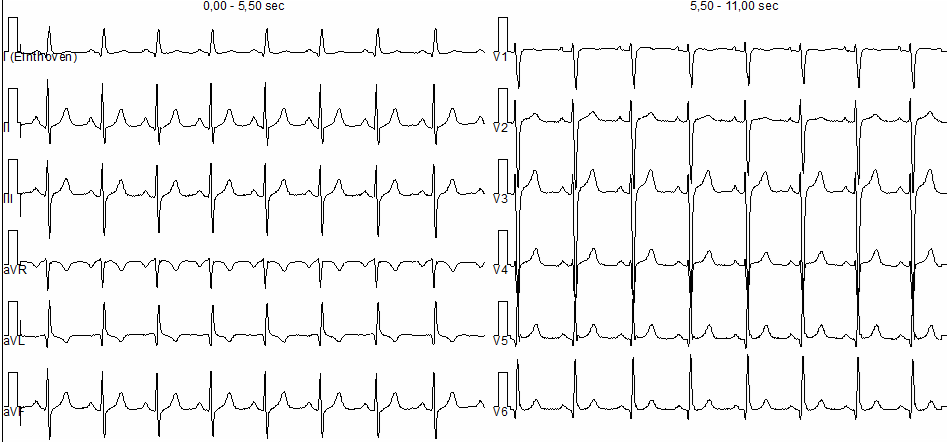
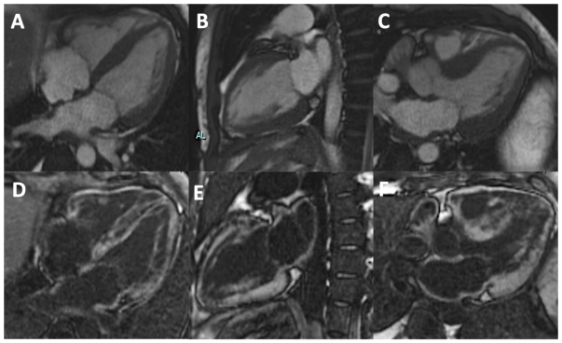
dispnea e addominalgia. All’ingresso si mostrava vigile con pressione arteriosa di 90/60 mmHg, frequenza cardiaca di 110 bpm, saturazione arteriosa 97% in aria ambiente, apiretico. Agli esami ematochimici si evidenziavano: D-dimero di 22180 ng/ml, moderata piastrinopenia (PLT 83000) e creatininemia di 1.9 mg/dl. L’emogasanalisi arteriosa era nei limiti di norma. All’elettrocardiogramma si riscontrava una tachicardia sinusale con blocco di branca destra, non noto in precedenza. La TAC del torace eseguita in regime d’urgenza evidenziava una tromboembolia polmonare con trombo non occludente disposto a cavaliere a carico dei rami
principali e multipli difetti di riempimento analoghi, non occludenti a livello delle diramazioni lobari e segmentarie di entrambi i lobi inferiore e superiore di destra (Figura 1).
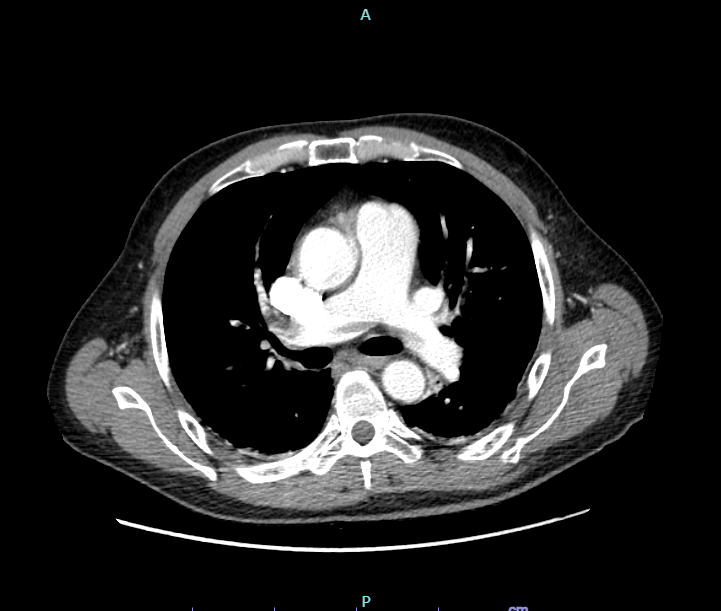
polmonare.
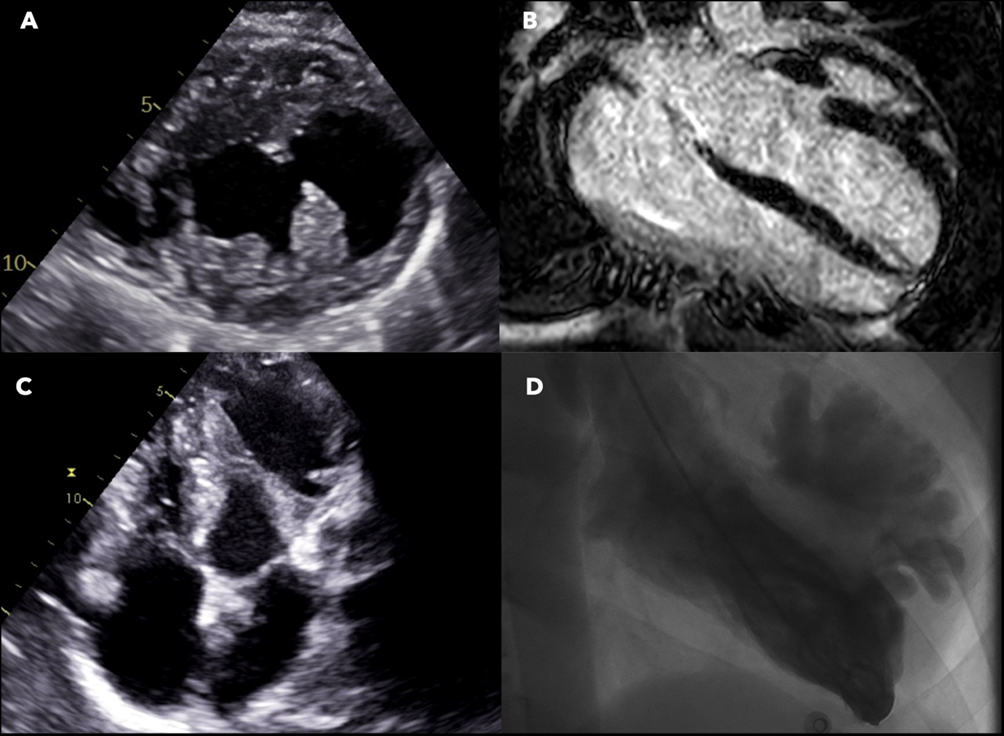
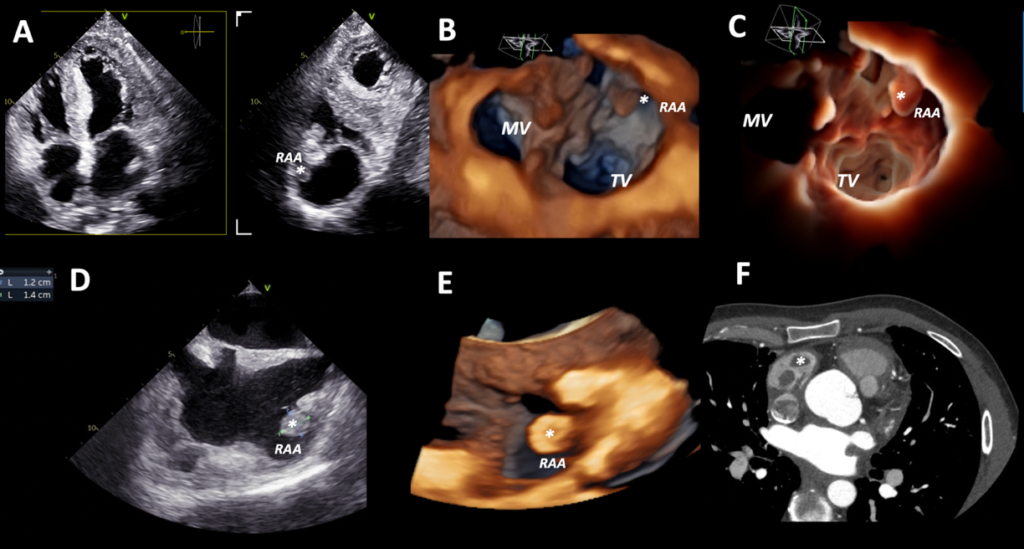
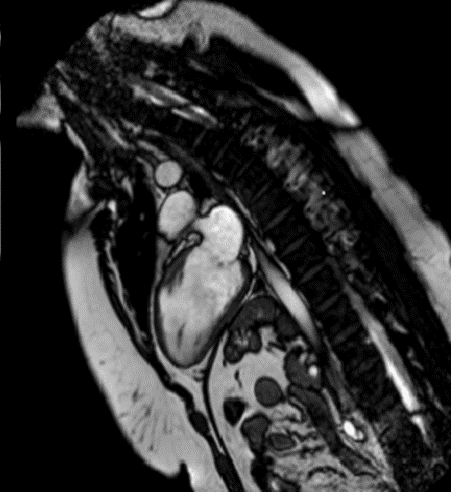
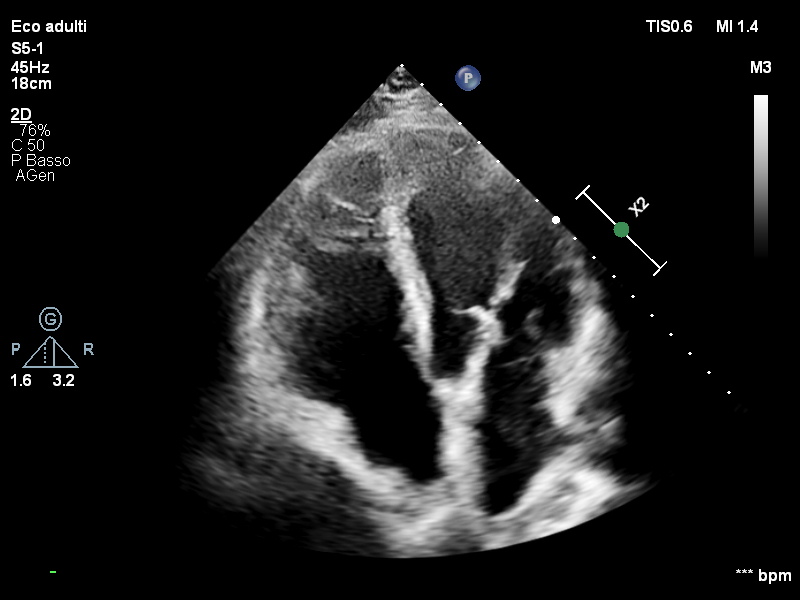
All’ecocardiogramma le sezioni destre risultavano dilatate e ipocinetiche con vena cava inferiore di 25 mm e non collabente. La funzione ventricolare sinistra risultava invece nei limiti di norma (Figura 2). Dopo poche ore di osservazione in Pronto Soccorso, il paziente si presentava soporoso, fortemente ipoteso (PA 70/40 mmHg), oligo-anurico e con compromissione degli scambi respiratori. Pertanto, veniva trasferito presso la nostra Unità di Terapia Intensiva Cardiologica.
Visto il quadro di tromboembolia polmonare a rischio elevato in presenza di controindicazione assoluta alla terapia fibrinolitica, risultava indicato il trattamento percutaneo con trombolisi reologica mediante AngioJet.
Il caso veniva discusso collegialmente con l’Oncologo di riferimento che confermava la prognosi del paziente superiore a 12 mesi e con il Neurochirurgo che, alla luce dell’assenza di focolai emorragici all’ultima RMN encefalo, non poneva controindicazioni al trattamento percutaneo e
alla terapia anticoagulante successiva.
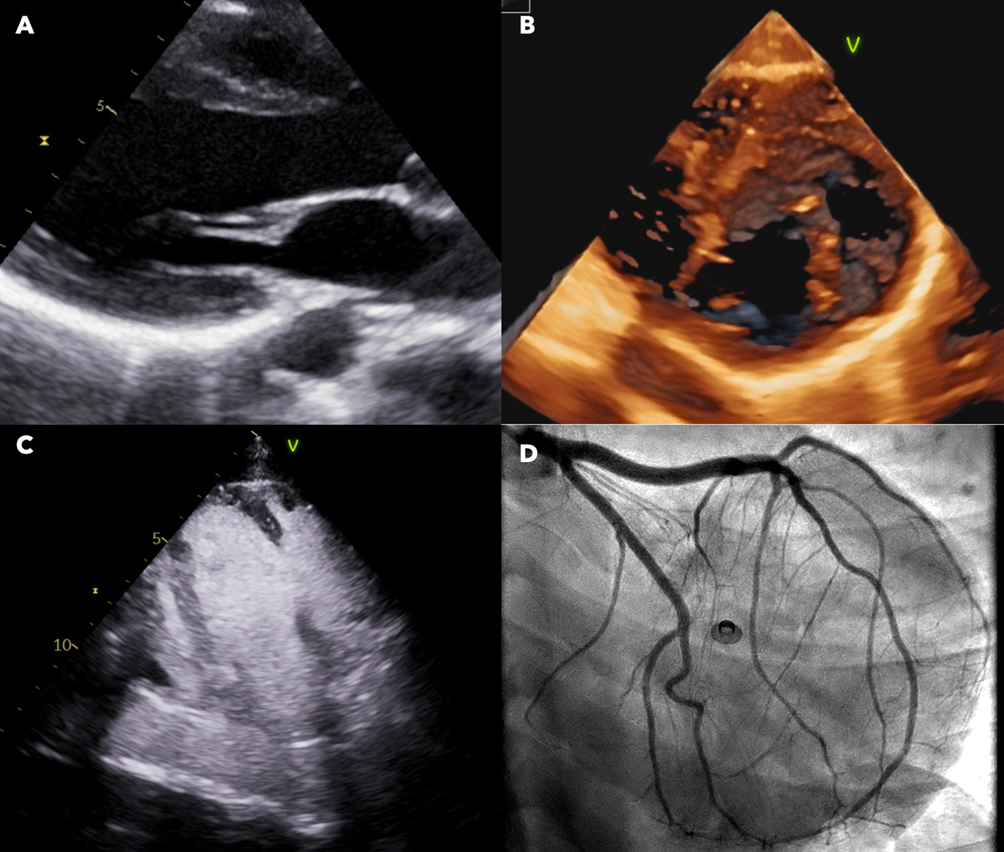
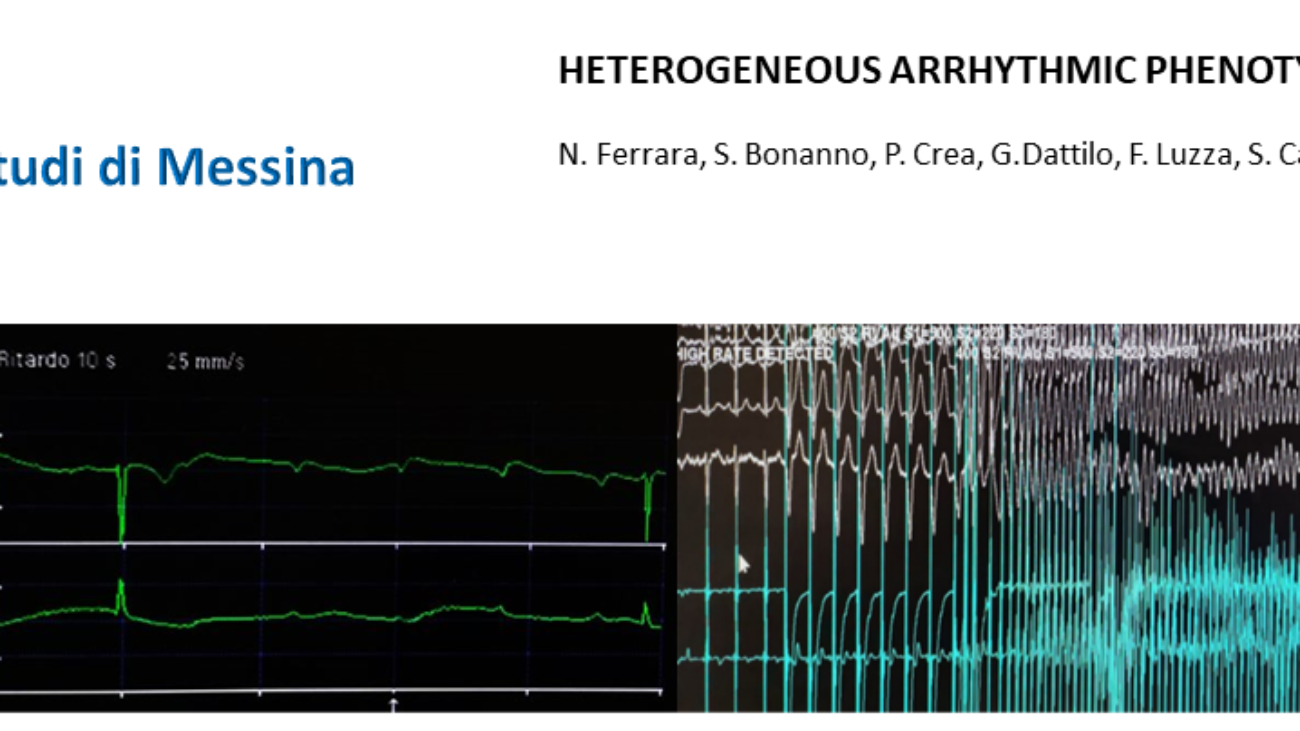
Il paziente veniva condotto in sala di Emodinamica dove, tramite accesso venoso femorale (8F), si eseguiva angiografia polmonare destra con evidenza di formazioni trombotiche a livello dei rami per il lobo medio e superiore. All’angiografia polmonare sinistra si evidenziavano
formazioni trombotiche a livello dei rami per il lobo inferiore e per la lingula (Figura 3 A. e C.).
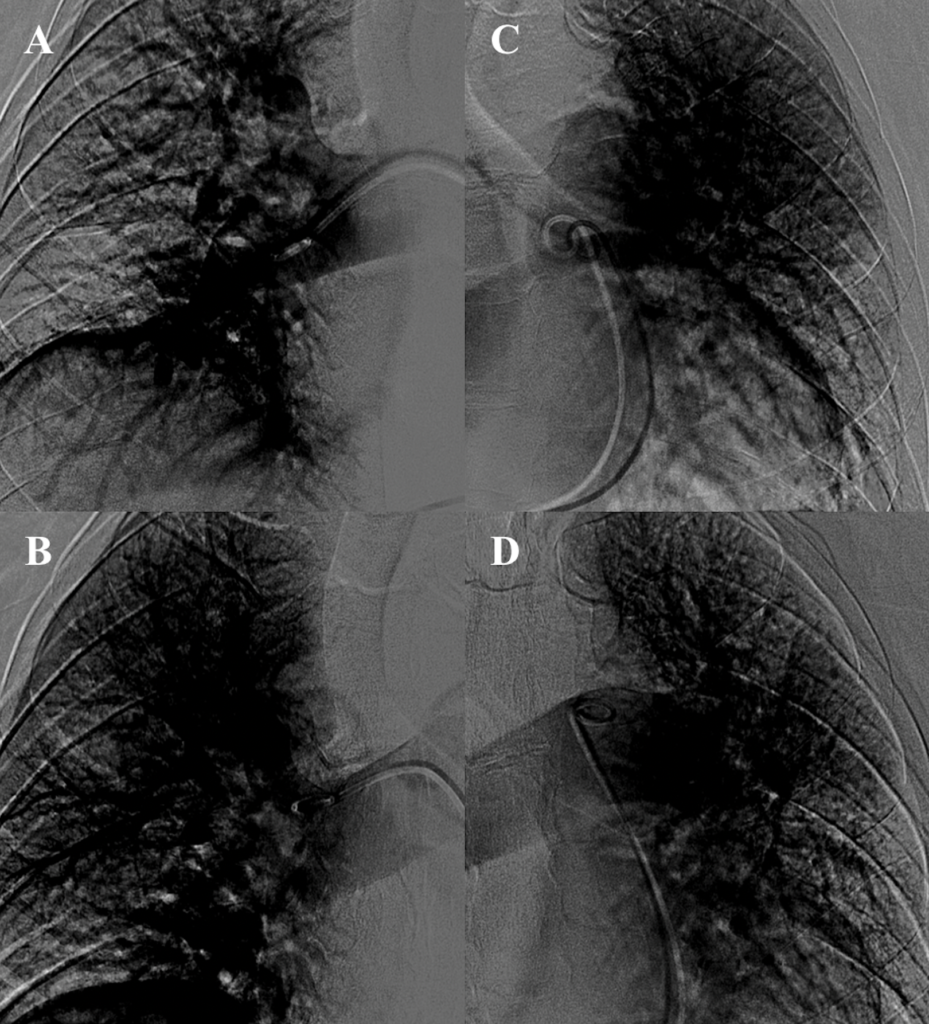
AngioJet. Si noti il ripristino del circolo polmonare in particolare a livello dei campi inferiore sinistro e
superiore/medio destro.
Tramite catetere destro e guida angiografica 0.35 mm si eseguivano multipli passaggi di AngioJet in entrambi i campi polmonari destro e sinistro, con completamento a livello del tronco
dell’arteria polmonare. Le successive angiografie hanno documentato un netto incremento della perfusione dei distretti interessati e contestualmente si otteneva un miglioramento delle condizioni cliniche, della pressione arteriosa con ripresa della diuresi spontanea.
In seguito, è stata intrapresa terapia con Eparina non frazionata in infusione continua a dosaggio anticoagulante a basso range. Durante il decorso clinico si assisteva a ripristino della piastrinopenia e miglioramento della funzionalità renale, in assenza di anemia o sanguinamenti maggiori. Ottenuta la stabilità clinica e strumentale, in seguito a nuova discussione collegiale, veniva sospesa eparina e si introduceva terapia anticoagulante orale con Edoxaban 60 mg.
Il paziente è stato successivamente trasferito in Medicina Oncologica, dalla quale è stato poi dimesso al domicilio in buone condizioni generali.
CONCLUSIONI
Il trattamento percutaneo dell’embolia polmonare, come l’AngioJet ed altri
dispositivi attualmente in via di sviluppo, rappresentano una valida opzione terapeutica nel paziente ad alto rischio con controindicazione assoluta o fallimento della terapia fibrinolitica. In questi casi l’approccio interventistico può essere la scelta meno invasiva e meno rischiosa
per il paziente.
BIBILIOGRAFIA
[1] Duffett L, Castellucci LA, Forgie MA. Pulmonary embolism: update on management and controversies. BMJ. 2020 Aug 5;370:m2177. doi: 10.1136/bmj.m2177. PMID: 32759284.
[2] Alexander R Lyon and others, 2022 ESC Guidelines on cardio-oncology developed in collaboration with the European Hematology Association (EHA), the European Society for Therapeutic Radiology and Oncology (ESTRO) and the International Cardio-Oncology Society (ICOS):
Developed by the task force on cardio-oncology of the European Society of Cardiology (ESC), European Heart Journal, Volume 43, Issue 41, 1 November 2022, Pages 4229–4361
[3] Stavros V Konstantinides and others, 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC), European Heart Journal, Volume 41, Issue 4, 21 January 2020, Pages 543–603
[4] Ajar Kochar , Brian A Bergmark, Catheter-directed interventions for pulmonary embolism, European Heart Journal. Acute Cardiovascular Care, Volume 11, Issue 9, September 2022, Pages 721–727
[5] AngioJet thrombectomy. Lee MS, Singh V, Wilentz JR, Makkar RR. s.l. : J Invasive Cardiol, 2004 Oct, Vol. 16(10):587–91.