Luca Barca1, Giuseppe Mascia2, Paolo Sartori2, Daniele Bianco2, Paolo Archetti1, Sofia Hassan1, Paolo Di Donna2, Italo Porto1,2
1 Department of Cardiology, Department of Internal Medicine, University of Genoa, Italy.
2 Department of Cardiology, Cardiovascular Disease Unit, IRCCS Ospedale Policlinico San Martino, Genova, Italy.
ABSTRACT
L’approccio ablativo trans-catetere è attualmente utilizzato nel trattamento delle tachicardie sopra ventricolari (TSV). Tuttavia, la presenza di precedenti lesioni ablative può cambiare il quadro di presentazione delle TSV e renderne difficile la diagnosi all’elettrocardiogramma (ECG).
Riportiamo il caso di un uomo di 62 anni sottoposto in precedenza ad ablazione dell’istmo cavo-tricuspidalico (ICT) per un flutter atriale tipico comune, presentatosi in pronto soccorso per dispnea e cardiopalmo con riscontro all’ECG di una tachicardia a complessi stretti con caratteristiche suggestive per recidiva di flutter atriale tipico comune. Tuttavia, lo studio elettrofisiologico e il mappaggio elettro-anatomico hanno permesso di definire la reale natura del substrato aritmico, compatibile con una tachicardia atriale focale, con conseguente trattamento ablativo e ripristino del ritmo sinusale.
INTRODUZIONE
L’elettrocardiogramma (ECG) di superficie è uno strumento fondamentale nella diagnosi delle tachicardie sopraventricolari (TSV) e l’approccio ablativo è una tecnica consolidata ed ampiamente utilizzata nel trattamento della maggior parte di queste aritmie [1]. Tuttavia, in caso di procedure ripetute per recidive aritmiche, la concomitante presenza di precedenti lesioni ablative può sottendere la presenza di differenti circuiti di propagazione dell’impulso e rendere più complessa la diagnosi differenziale tra i diversi tipi di TSV, condizionandone il trattamento.
CASO CLINICO
Presentiamo il caso di un uomo di 62 anni fumatore attivo, dislipidemico e con storia di tachicardiomiopatia secondaria a flutter atriale tipico comune, già sottoposto ad una procedura di ablazione dell’istmo cavo-tricuspidalico (ICT) a febbraio 2021, con successivo recupero della frazione d’eiezione ventricolare sinistra.
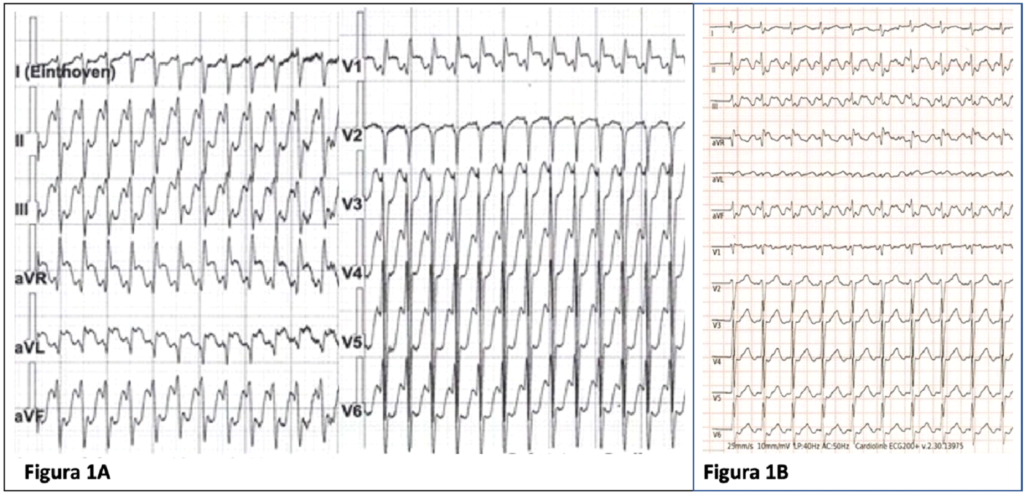
Nel dicembre 2022 il paziente si presentava in pronto soccorso per dispnea e cardiopalmo. All’ECG si riscontrava una tachicardia a complessi stretti a 290 bpm (Figura 1A) non responsiva alle manovre manovre vagali e alla somministrazione adenosina.
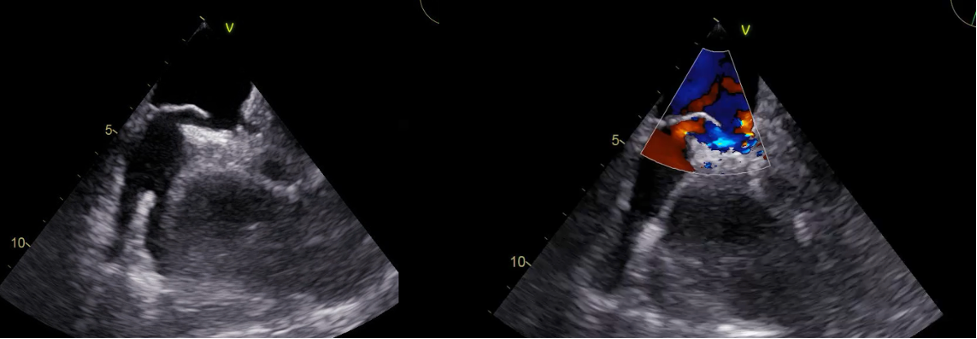
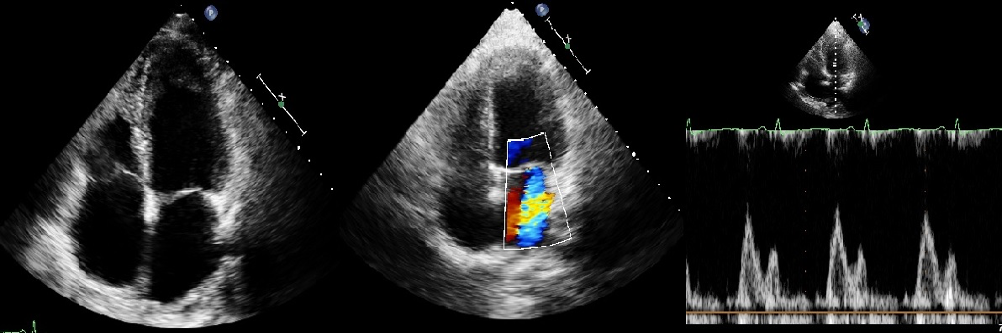
Al fine di rallentare la frequenza cardiaca, veniva quindi somministrata terapia beta-bloccante. All’ECG si osservava quindi un rallentamento della conduzione atrio-ventricolare con evidenza di onde atriali a denti di sega nelle derivazioni inferiori compatibile, in prima ipotesi, con la diagnosi di recidiva di flutter atriale tipico comune a conduzione 2:1 (Figura 1B). All’ecocardiogramma si documentava una moderata disfunzione sistolica del ventricolo sinistro.
In considerazione della persistenza dell’aritmia, della sintomatologia invalidante e della pregressa diagnosi di tachicardiomiopatia, il paziente veniva sottoposto a studio elettrofisiologico e mappaggio elettro-anatomico, mirato a verificare la presenza di recidiva di conduzione lungo la precedente linea ablativa a livello dell’ICT.
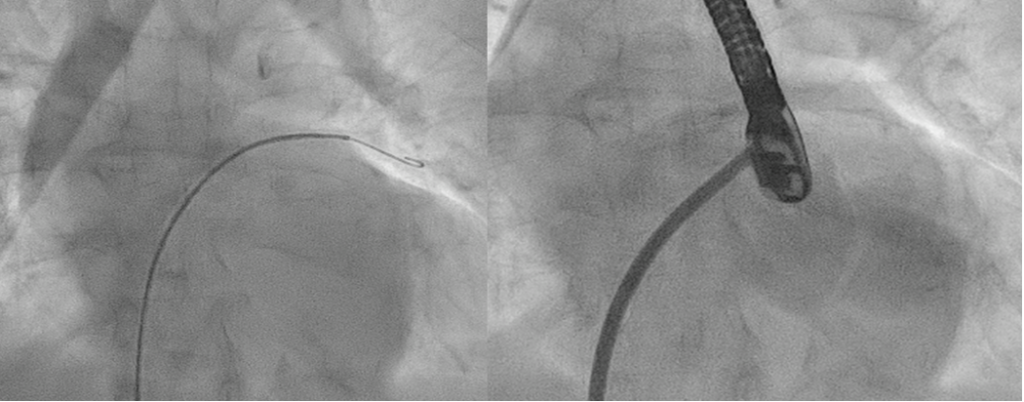
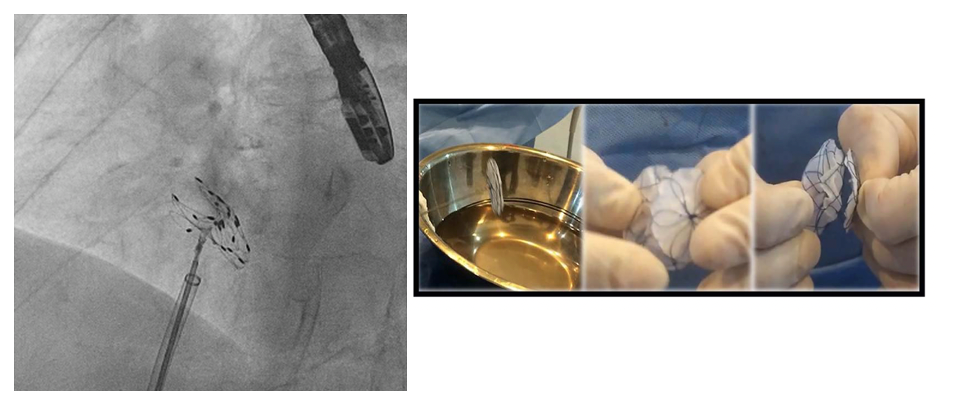
In sala di elettrofisiologia, dopo aver posizionato un catetere decapolare in seno coronarico come riferimento, si eseguiva il mappaggio dell’aritmia in atrio destro, con documentazione di blocco bidirezionale lungo l’ICT e con dimostrazione di un microcircuito focale in prossimità della porzione settale prossimale all’ostio del seno coronarico. Tale attività mimava un meccanismo di macrorientro con orientamento antiorario intorno all’anello tricuspidalico (Figura 2A) caratteristico dell’attivazione antioraria propria del flutter atriale tipico comune.
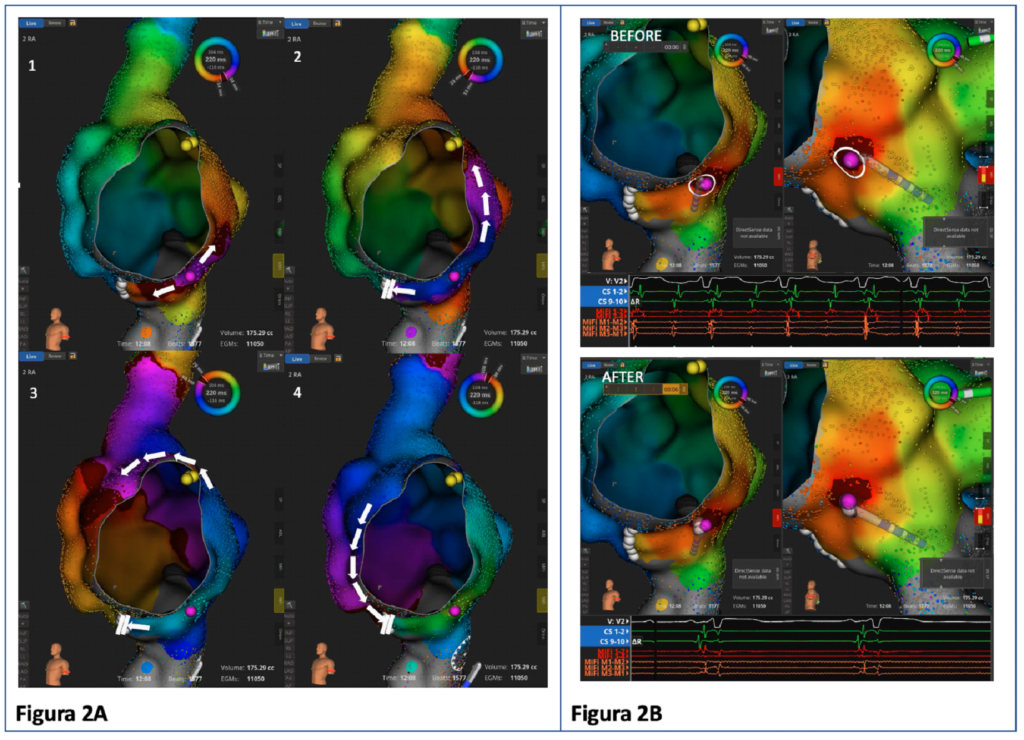
Si procedeva quindi all’erogazione di radiofrequenza su tale focus, con conseguente interruzione dell’aritmia e ripristino di ritmo sinusale stabile (Figura 2B).
A seguito della procedura, il paziente si è mantenuto in ritmo sinusale, stabile e asintomatico per cardiopalmo con recupero della funzione sistolica ventricolare sinistra al successivo follow-up ecocardiografico.
DISCUSSIONE
Il flutter atriale tipico comune è una delle TSV più frequenti, il cui trattamento ablativo si caratterizza per un elevato tasso di successo, tale da porre un’indicazione di prima linea nel setting cronico nei pazienti sintomatici e/o con tachicardiomiopatia [1]. Ciò si basa su una chiara comprensione del suo circuito elettro-anatomico e della dipendenza critica dall’ICT [2]. Infatti, il macrorientro alla base del flutter tipico è localizzato in atrio destro attorno alla valvola tricuspide. Posteriormente, il circuito dell’aritmia è delimitato da alcune barriere anatomiche, tra cui la cresta terminale, la vena cava inferiore e l’ostio del seno coronarico. Tali strutture costituiscono una sorta di binari nei quali si incanala l’impulso elettrico che determina la persistenza e il mantenimento del circuito di rientro.
La documentazione di una linea di blocco bidirezionale dell’ICT ottenuta con l’ablazione transcatetere è associata ad un’alta percentuale di successo ed a un miglioramento della qualità della vita nei pazienti con flutter tipico [3-5].
All’ECG, il flutter atriale tipico comune è caratterizzato dal classico aspetto delle onde atriali (onde F) a denti di sega (negative/positive) nelle derivazioni DII, DIII e aVF senza linea isoelettrica interposta. Tale pattern è secondario all’attivazione atriale, diretta dall’alto verso il basso nella parete laterale e dal basso verso l’alto nella zona settale secondo un andamento antiorario. Al contrario, tale circuito si attiva in senso orario nella forma “reverse” o “non comune”.
Tali caratteristiche ECG permettono, generalmente, la distinzione rispetto tra il flutter tipico e altre TSV come le tachicardie atriali (TA) focali. Le TA sono infatti secondarie alla presenza di foci ectopici che, nell’atrio destro, tendono a verificarsi lungo l’asse lungo della crista terminalis, nella regione para-hissiana, intorno all’annulus della tricuspide e meno frequentemente all’ostio del seno coronarico [6].
Nella maggior parte dei casi di TA focale è possibile osservare un’onda P con un intervallo isoelettrico intermedio, permettendone così di valutarne la polarità e la morfologia [7].
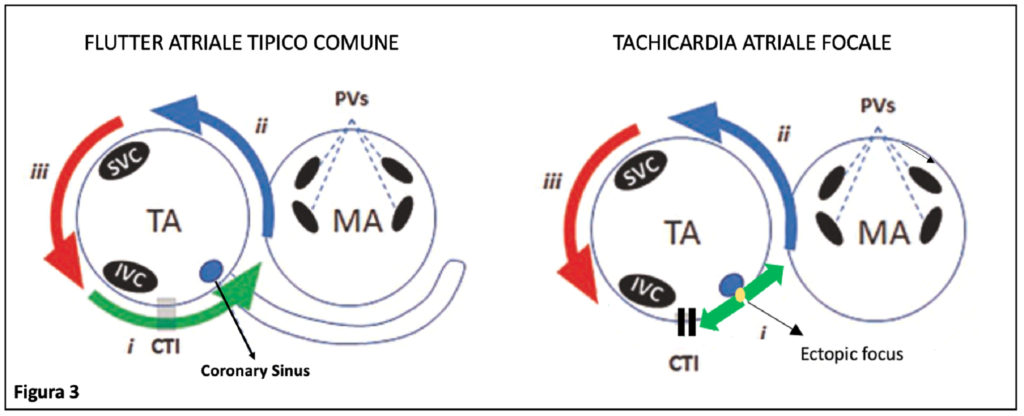
Tuttavia, nel caso specifico, una TA ad origine dalla parte inferiore del setto interatriale, in prossimità dell’ostio del seno coronarico, in presenza della linea di blocco bidirezionale dell’ICT, mimava il circuito di attivazione del flutter atriale tipico (Figura 3), determinando difficoltà nella diagnosi differenziale all’ECG di presentazione.
CONCLUSIONI
Nel caso presentato, lo studio elettrofisiologico e il mappaggio elettro-anatomico durante l’aritmia sono stati fondamentali nella diagnosi differenziale tra una recidiva di conduzione lungo l’ICT – precedentemente trattato con ablazione trans-catetere per flutter atriale tipico comune – ed una forma di TA focale ad origine dalla parte inferiore del setto interatriale, in prossimità dell’ostio del seno coronarico. Questo ha permesso di trattare efficacemente l’aritmia con ripristino del ritmo sinusale stabile e recupero della funzione sistolica ventricolare sinistra.
BIBLIOGRAFIA
- Brugada J, Katritsis DG, Arbelo E, et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J. 2020;41(5):655-720. doi:10.1093/eurheartj/ehz467
- Olgin JE, Kalman JM, Fitzpatrick AP, Lesh MD. Role of right atrial endocardial structures as barriers to conduction during human type I atrial flutter. Activation and entrainment mapping guided by intracardiac echocardiography. Circulation 1995;92:18391848.
- Spector P, Reynolds MR, Calkins H, et al. Meta-analysis of ablation of atrial flutter and supraventricular tachycardia. Am J Cardiol. 2009;104(5):671-677.
doi:10.1016/j.amjcard.2009.04.040 - Pe´rez FJ, Schubert CM, Parvez B, Pathak V, Ellenbogen KA, Wood MA. Longterm outcomes after catheter ablation of cavo-tricuspid isthmus dependent atrial flutter. A meta-analysis. Circ Arrhythm Electrophysiol 2009;2:393401.
- Wood KA, Stewart AL, Drew BJ, Scheinman MM, Froelicher ES. Patient perception of symptoms and quality of life following ablation in patients with supraventricular tachycardia. Heart Lung 2010;39:1220
- Kistler PM, Fynn SP, Haqqani H, et al. Focal atrial tachycardia from the ostium of the coronary sinus: electrocardiographic and electrophysiological characterization and radiofrequency ablation. J Am Coll Cardiol. 2005;45(9):1488-1493. doi:10.1016/j.jacc.2005.01.042
- Roberts-Thomson KC, Kistler PM, Kalman JM. Focal atrial tachycardia I: clinical features, diagnosis, mechanisms, and anatomic location. Pacing Clin Electrophysiol. 2006;29(6):643-652. doi:10.1111/j.1540-8159.2006.00413.x