Andrea Raffaele Munafò, MD1,2, Alessandro Mandurino Mirizzi, MD1, Claudia Raineri, MD1, Giulia Magrini, MD1, Fabrizio Gazzoli, MD1, Martina Moschella, MD1, Romina Frassica, MD1, Stefano Ghio, MD1, Maurizio Ferrario, MD1, Marco Ferlini, MD1, Gabriele Crimi, MD1.
1 Division of Cardiology, Fondazione IRCCS Policlinico San Matteo Foundation, Pavia, Italy.
2 University of Pavia, Pavia, Italy.
Caso clinico
Una donna di 55 anni, con diagnosi di cardiomiopatia dilatativa dal 1997, veniva riferita al nostro centro nel gennaio 2018 per un quadro di scompenso cardiaco avanzato in presenza di insufficienza valvolare mitralica (IM) di grado severo. Al momento della nostra valutazione, la paziente era già in terapia medica ottimizzata al massimo dosaggio tollerato (ARNi incluso) ed era già stata sottoposta a terapia di resincronizzazione cardiaca (CRT-D). Nonostante questo, la paziente presentava un peggioramento dei sintomi dello scompenso (classe funzionale NYHA III), necessitando nei 6 mesi precedenti di 2 ricoveri ospedalieri dove era stata trattata con terapia endovenosa con furosemide e sodio nitroprussiato (NTP).
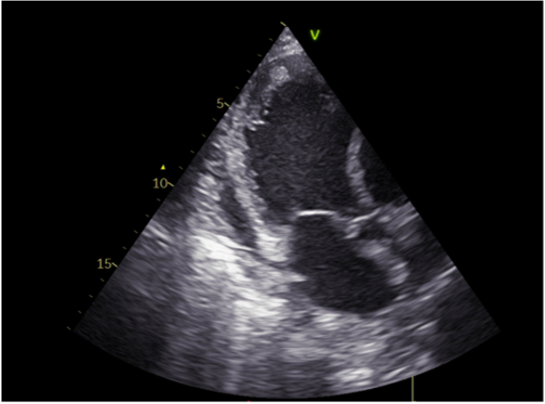
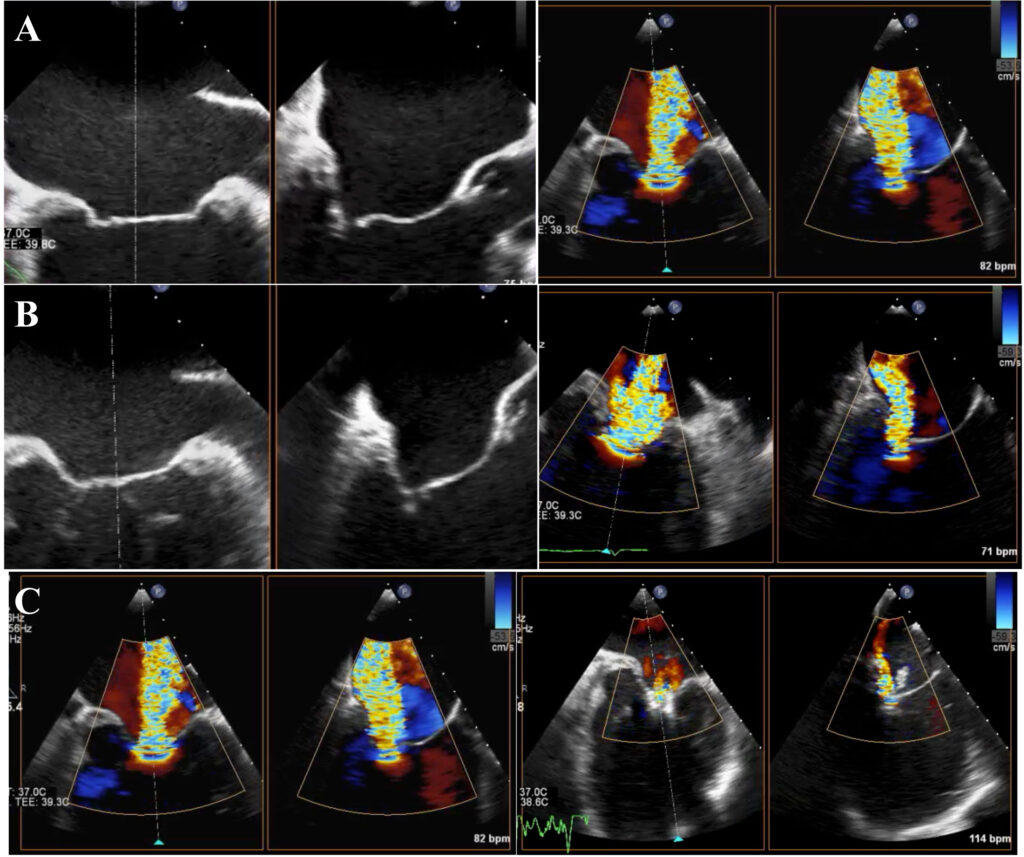
L’ecocardiogramma eseguito al momento del ricovero mostrava un ventricolo sinistro severamente dilatato (volume telediastolico indicizzato 246 ml/m2, diametro telediastolico 80 mm, diametro telesistolico 74 mm), con una severa riduzione della funzione sistolica globale (FE 20%), una significativa dilatazione dell’atrio sinistro (volume indicizzato 82 ml/m2), ed una IM di grado severo. Quest’ultima era caratterizzata da un’eziologia mista: dilatazione anulare (pattern principale) e rimaneggiamento post-reumatico delle corde tendinee e dei lembi valvolari, condizionante un tethering asimmetrico dei lembi con un gap di coaptazione di circa 4 mm (figura 1A). La funzione e la dimensione del ventricolo destro erano ancora preservate (TAPSE 20 mm).
La paziente veniva quindi sottoposta ad un cateterismo cardiaco destro che mostrava un quadro emodinamico caratterizzato da un basso indice cardiaco (1,66 l/min/m2), una lieve ipertensione polmonare post-capillare (PAP media 26 mmHg, pressione di incuneamento 23 mmHg, resistenze polmonari 1.1Wood Units), ed una normale pressione atriale destra (5 mmHg).
In considerazione della gravità del quadro clinico-strumentale, discusso il caso in Heart Team, si decideva di non candidare la paziente ad un intervento di riparazione chirurgica della valvola mitrale, e di inserirla in lista d’attesa per il trapianto di cuore (HTPL). Inoltre, in considerazione del gap di coaptazione tra i lembi mitralici di circa 4 mm, una possibile riparazione percutanea del vizio mitralico (TMVR) con il sistema MitraClip veniva ritenuta non fattibile. Tuttavia, in considerazione della sintomatologia ingravescente e della scarsa qualità di vita della paziente nonostante la terapia medica, si decise di mettere in atto una strategia terapeutica che potesse ridurre il gap di coaptazione tra i lembi mitralici, al fine di eseguire una TMVR come “terapia ponte” al HTPL.
Quattro giorni prima dell’intervento di TMVR, la paziente veniva quindi sottoposta ad una infusione continua di NTP per 48 h, seguita da un ciclo di infusione di levosimendan per 24 h. Il giorno prima della procedura, veniva infine posizionato il contropulsatore aortico (IABP, con frequenza 1:1). Al controllo con l’ecocardiogramma transesofageo (ETE) eseguito 6 ore dopo il posizionamento dell’IABP, il gap di coaptazione era stato ridotto a 2.2 mm (figura 1B), in assenza però di una riduzione della severità dell’IM e/o di un miglioramento della funzione sistolica ventricolare sinistra. Mantenendo il supporto del circolo con l’IAPB, si procedeva pertanto a TMVR con il posizionamento di due clip in assenza di complicanze. Al ETE post-procedurale si apprezzava un IM residua di grado lieve, con normalizzazione del flusso a livello delle vene polmonari (figura 1C). Al cateterismo cardiaco destro di controllo, veniva osservato un miglioramento immediato del 25% dell’indice cardiaco.
Nei 18 mesi successivi, la paziente è andata incontro ad un progressivo miglioramento clinico (classe funzionale NYHA I) in assenza di nuovi ricoveri per riacutizzazione di scompenso cardiaco, tanto da richiedere l’esclusione dalla lista di attesa per HTPL.
Discussione
Il HTPL resta ad oggi la migliore opzione terapeutica per i pazienti con scompenso cardiaco avanzato. Tuttavia, a causa dei tempi di attesa sempre più lunghi, i pazienti in lista per HTPL spesso necessitano di “terapie ponte” al fine di migliorare la loro condizione clinica e la qualità di vita. Mentre altri trattamenti farmacologici e/o meccanici (es. LVAD) sono comunemente utilizzati come terapie ponte al trapianto nella pratica clinica di tutti i giorni, poche evidenze1-3 sono ad oggi disponibili riguardo l’uso di TMVR con MitraClip nei pazienti con scompenso cardiaco avanzato e concomitante IM severa, in attesa di HTPL. Il risultato ottenuto nella paziente del caso clinico sopra descritto sottolinea come, in questa tipologia di pazienti, l’IM funzionale non svolga soltanto un ruolo principale nell’accentuazione dei sintomi dello scompenso e nell’aumento del tasso delle ospedalizzazioni, ma che possa anche incidere sulla prognosi a lungo termine4. La TMVR con MitraClip associata alla terapia medica ottimizzata può quindi garantire un miglioramento della sopravvivenza di questi pazienti, come dimostrato dai recenti risultati del COAPT trial5.
In conclusione, nei pazienti con scompenso cardiaco avanzato ed IM di grado severo, che sono ancora sintomatici nonostante la terapia medica, e per i quali il HTPL rimane il trattamento definitivo più efficace, la TMVR con MitraClip può rappresentare un’ottima strategia di terapia ponte, garantendo una stabilizzazione clinica ed emodinamica, e soprattutto migliorandone la sopravvivenza.
References
1. Berardini A, Biagini E, Saia F, et al. Percutaneous mitral valve repair: The last chance for symptoms improvement in advanced refractory chronic heart failure? Int J Cardiol. 2017;228:191-197.
2. Crimi G, Gritti V, Ghio S, et al. MitraClip procedure as “bridge to list”, the ultimate therapeutic option for end-stage heart failure patients not eligible for heart transplantation due to severe pulmonary hypertension. Pulm Circ. 2018;8(4).
3. Godino C, Munafò A, Scotti A, et al. MitraClip in secondary mitral regurgitation as a bridge to heart transplantation: 1-year outcomes from the International MitraBridge Registry. J Heart Lung Transplant. 2020;39(12):1353-1362.
4. Goliasch G, Bartko PE, Pavo N, et al. Refining the prognostic impact of functional mitral regurgitation in chronic heart failure. Eur Heart J. 2018;39(1):39-46.
5. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med. 2018;379(24):2307-2318.