Alessandro Albini1,Vincenzo Livio Malavasi1, Marco Vitolo1,2, Jacopo Francesco Imberti1, Marco Marietta3, Gregory Y.H. Lip2,4 and Giuseppe Boriani1
1 Cardiology Division, Department of Biomedical, Metabolic and Neural Sciences, University of Modena and Reggio Emilia, Policlinico di Modena, Modena, Italy
2 Liverpool Centre for Cardiovascular Science, University of Liverpool and Liverpool Heart & Chest Hospital, Liverpool, United Kingdom
3 Department of Oncology and Haematology, University Hospital, Modena, Italy
4Aalborg Thrombosis Research Unit, Department of Clinical Medicine, Aalborg University, Aalborg, Denmark.
Abstract
La fibrillazione atriale postoperatoria (POAF) nel contesto della chirurgia non cardiaca (NCCH) è frequente e correlata con un peggiore outcome intraospedaliero. Meno solidi sono i dati sul significato a lungo termine di questa aritmia. Presentiamo la recente metanalisi della letteratura realizzata dal nostro gruppo. Lo sviluppo di POAF è risultato correlato ad un aumento di 4 volte del rischio di stroke. Inoltre, la mortalità nel gruppo POAF è risultata significativamente più alta rispetto ai pazienti post NCCH senza sviluppo di POAF. Tali dati mostrano che la sistematica ricerca della POAF potrebbe contribuire a migliorare l’outcome di questo cluster di pazienti; inoltre appare necessario identificare strategie di prevenzione e valutare l’impatto della terapia anticoagulante nel gruppo ad elevato rischio tromboembolico.
Commento
La fibrillazione atriale postoperatoria (POAF) è definita come fibrillazione atriale (AF) di nuovo riscontro nel contesto postoperatorio ed ha una incidenza che raggiunge il 50% in cardiochirurgia (CCH) e il 15% in chirurgia non cardiaca (NCCH)(1,2). Tale aritmia si associa a maggiori complicanze postoperatorie, maggiore spesa sanitaria e mortalità intra-ricovero (2,3). Nel contesto CCH, la POAF viene considerata una conseguenza diretta della manipolazione del tessuto cardiaco, mentre in NCCH può essere interpretata come l’effetto di stressors fisiologici su un substrato atriale predisposto e potenzialmente protrombotico. (4,5) Visto il numero esiguo di dati solidi riguardanti il rischio tromboembolico a lungo termine, legato all’interpretazione della POAF come un’ entità benigna e transitoria, rimane forte incertezza sull’ utilizzo della terapia anticoagulante in pazienti recentemente operati. Non sono disponibili ad oggi chiare indicazioni sull’anticoagulazione a lungo termine in questi pazienti. Il nostro gruppo ha pertanto realizzato una metanalisi analizzando in primis stroke e mortalità nei pazienti POAF e senza POAF nel decorso postoperatorio della NCCH e in secondo luogo dati sulla recidiva di AF nei pazienti POAF.
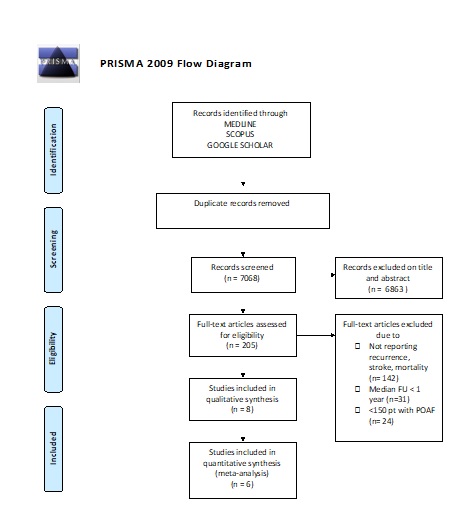
Legenda: FU, follow-up; n, number; POAF, post operative atrial fibrillation; pt, patients.
La nostra strategia di ricerca in Medline, Scopus e Google Scholar è constata di 2 step: abbiamo dapprima identificato studi che riportassero gli outcome di interesse (stroke, mortalità, recidiva di AF) escludendo coorti CCH e di chirurgia carotidea/aortica. Successivamente abbiamo ristretto l’analisi a studi che avessero almeno 12 mesi di follow-up e almeno 150 pazienti con diagnosi di POAF. Inoltre, condizione necessaria per l’accettazione dello studio era l’esclusione nelle analisi di pazienti con pregressa storia di AF. La revisione sistematica ha identificato 8 studi (5, 6-12) per un totale di 3.718.587 pazienti, 7 studi osservazionali e 1 trial randomizzato controllato, mentre 6 studi sono stati meta-analizzati utilizzando il modello random-effects di Mantel-Haenszel (Figura 1).
Per quanto riguarda l’outcome stroke, l’analisi ha riguardato 2.186.644 pazienti; si sono registrati 6.766 eventi, 240 nella coorte POAF e 6.526 nella coorte senza POAF. La POAF è risultata associata con un rischio 4 volte più alto di stroke a 12 mesi (OR 4.05; 95% CI 2.91-5.62). L’analisi della mortalità ha riguardato 18.405 pazienti, la POAF è risultata associata ad un rischio 3.6 volte maggiore di mortalità a 12 mesi (OR 3.59; CI 95% 2.84-4.53) (Figura 2).
I dati sulla recidiva di fibrillazione atriale sono risultati troppo eterogenei in termini metodologici per poter essere meta-analizzati; negli studi che hanno rilevato la recidiva a 12 mesi, al netto delle differenze metodologiche, questa si attestava tra il 37 e il 39%.
La metanalisi del nostro gruppo è stata indirizzata alla identificazione del significato prognostico a lungo termine della POAF, una delle aritmie che più frequentemente sono causa di consulto cardiologico le cui implicazioni, soprattutto in termini di tromboprofilassi, sono più incerte.
Il contesto della chirurgia non cardiaca è peculiare per molteplici aspetti. In primis, differisce dalla chirurgia cardiaca per l’assenza della diretta manipolazione del tessuto cardiaco; inoltre, nel setting cardiochirurgico studi precedenti sul rischio precoce e tardivo di stroke hanno dato risultati contraddittori (13,14). Il contesto NCCH sembra condividere aspetti fisiopatologici con altri setting acuti in cui lo sviluppo di AF è correlato ad una prognosi peggiore, come la polmonite o la sepsi (15-16).
Ad ulteriore supporto degli effetti a lungo termine di episodi di AF transitori vi sono i dati riguardanti episodi di elevata frequenza atriale (AHRE) registrata da dispositivi impiantabili (17). In modo analogo agli studi sugli AHRE, anche negli studi da noi analizzati i pazienti che sviluppavano AF clinica nel follow-up venivano esclusi, per evidenziare il rischio conferito dalla sola POAF.
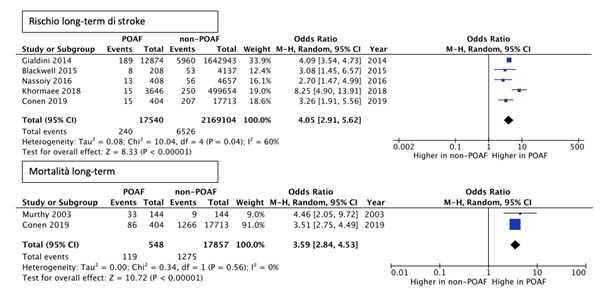
Legenda: CI, confidence interval; M-H, Mantel-Haenszel; POAF, post operative atrial fibrillation
Una strategia di tromboprofilassi analoga alla AF clinica sembra ragionevole in questo contesto, sebbene non siano al momento disponibili dati tratti da RCT. Un grande studio osservazionale danese ha dimostrato che il rischio tromboembolico di POAF e AF è analogo sul lungo termine e che l’incidenza dell’outcome è minore nei pazienti anticoagulati (7). In linea con i dati della letteratura e con il risultato della nostra metanalisi, le linee guida della società europea di cardiologia (ESC) 2020 raccomandano con classe di raccomandazione IIa e livello di evidenza B, la profilassi long-term nei pazienti che sviluppano FA postoperatoria in setting NCCH a rischio tromboembolico elevato (18).
La POAF è correlata ad aumentata mortalità a breve termine (2) e la nostra analisi ha mostrato come anche la mortalità a lungo termine sia influenzata da tale evento. Sulla base del forte impatto prognostico, è ragionevole valutare strategie sistematiche per la ricerca di FA nel postoperatorio, soprattutto nelle popolazioni notoriamente a rischio più elevato (sesso maschile, afroamericani, età avanzata, comorbidità cardiache e respiratorie). L’utilizzo di score predittivi per lo sviluppo di POAF (e.g.: POAF score, CHA2DS2-VASc, CHADS2) e strategie di prevenzione farmacologica (betabloccanti, amiodarone, agenti antiossidanti) sono stati proposti, ma al momento non sono disponibili dati solidi tali da raccomandarne l’applicazione sistematica.
Conclusioni
La POAF nel contesto non cardiochirurgico è un’aritmia frequente e comporta un rischio tromboembolico e di mortalità consistente a lungo termine. L’impatto prognostico di tale aritmia dovrebbe spingere alla sua ricerca sistematica nel postoperatorio, allo sviluppo di efficaci strategie preventive e alla valutazione della terapia anticoagulante long-term nei pazienti ad elevato rischio tromboembolico.
Bibliografia
- Dobrev D, Aguilar M, Heijman J, Guichard JB, Nattel S. Postoperative atrial fibrillation: mechanisms, manifestations and management. Nat Rev Cardiol 2019;16(7):417–36.
- Bhave PD, Goldman LE, Vittinghoff E, Maselli J, Auerbach A. Incidence, predictors, and outcomes associated with postoperative atrial fibrillation after major noncardiac surgery. Am Heart J 2012;164(6):918–24.
- Vallurupalli S, Shanbhag A, Mehta JL. Controversies in postoperative atrial fibrillation after noncardiothoracic surgery: clinical and research implications. Clin Cardiol. 2017;40(5):329–32.
- Kaireviciute D, Aidietis A, Lip GYH. Atrial fibrillation following cardiac surgery: Clinical features and preventative strategies. Eur Heart J. 2009;30(4):410–25
- Gialdini G, Nearing K, Bhave PD, Bonuccelli U, Iadecola C, Healey JS, et al. Perioperative atrial fibrillation and the long-term risk of ischemic stroke. JAMA – J Am Med Assoc. 2014;312(6):616–22.
- Butt JH, Olesen JB, Havers-Borgersen E, Gundlund A, Andersson C, Gislason GH, et al. Risk of Thromboembolism Associated With Atrial Fibrillation Following Noncardiac Surgery. J Am Coll Cardiol. 2018;72(17):2027–36.
- Wang EY, Hulme OL, Khurshid S, Weng LC, Choi SH, Walkey AJ, et al. Initial Precipitants and Recurrence of Atrial Fibrillation. Circ Arrhythmia Electrophysiol. 2020;(March)
- Murthy SC, Law S, Whooley BP, Alexandrou A, Chu KM, Wong J. Atrial fibrillation after esophagectomy is a marker for postoperative morbidity and mortality. J Thorac Cardiovasc Surg. 2003;126(4):1162–7.
- Blackwell RH, Ellimoottil C, Bajic P, Kothari A, Zapf M, Kliethermes S, et al. Postoperative atrial fibrillation predicts long-term cardiovascular events after radical cystectomy. J Urol. 2015;194(4):944–9.
- Nassoiy SP, Blackwell RH, Kothari AN, Besser S, Gupta GN, Kuo PC, et al. New onset postoperative atrial fibrillation predicts long-term cardiovascular events after gastrectomy. Am J Surg. 2016;211(3):559–64.
- Khormaee S, Do HT, Mayr Y, Gialdini G, Kamel H, Lyman S, et al. Risk of Ischemic Stroke After Perioperative Atrial Fibrillation in Total Knee and Hip Arthroplasty Patients. J Arthroplasty. 2018;33(9):3016–9.
- Conen D, Alonso-Coello P, Douketis J, Chan MTV, Kurz A, Sigamani A, et al. Risk of stroke and other adverse outcomes in patients with perioperative atrial fibrillation 1 year after non-cardiac surgery. Eur Heart J. 2020;41(5):645–51
- Mariscalco G, Klersy C, Zanobini M, Banach M, Ferrarese S, Borsani P, et al. Atrial fibrillation after isolated coronary surgery affects late survival. Circulation. 2008;118(16):1612–8
- Ahlsson A, Fengsrud E, Bodin L, Englund A. Postoperative atrial fibrillation in patients undergoing aortocoronary bypass surgery carries an eightfold risk of future atrial fibrillation and a doubled cardiovascular mortality. Eur J Cardio-thoracic Surg. 2010;37(6):1353–9.
- Pieralli F, Biondo B, Vannucchi V, Falcone M, Antonielli E, De Marzi G, et al. Performance of the CHA 2 DS 2 -VASc score in predicting new onset atrial fibrillation during hospitalization for community-acquired pneumonia. Eur J Intern Med. 2019;62(January):24–8
- Hu WS, Lin CL. Risk of incident atrial fibrillation after a prior critical illness: A retrospective cohort study. Eur J Intern Med. 2019;60(April):90
- Vitolo, M., Imberti, J. F., Maisano, A., Albini, A., Bonini, N., Valenti, A. C., Malavasi, V. L., Proietti, M., Healey, J. S., Lip, G. Y., & Boriani, G. (2021). Device-detected atrial high rate episodes and the risk of stroke/thrombo-embolism and atrial fibrillation incidence: a systematic review and meta-analysis. European journal of internal medicine, 92, 100–106.
- Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström-Lundqvist C, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020;1–126.