Angelica Cersosimo1, Enrico Vizzardi1, Antonino Milidoni1, Ashraf Ahmed1,2, Giuliana Cimino1, Ludovica Amore1, Riccardo Inciardi1, Gianmarco Arabia1
1 Cardiology Unit, Department of Medical and Surgical Specialties, Radiological Sciences and Public Health, University of Brescia, Brescia, Italy2 Cardiology Department, Faculty of Medicine, Alexandria University, Alexandria, Egypt
Abstract
L’ipertensione polmonare è caratterizzata da un aumento delle pressioni arteriose polmonari con dilatazione dell’arteria polmonare e del ventricolo destro. Riportiamo il caso di una donna di 47 anni affetta da ipertensione polmonare in terapia dal 2018 e ricoverata in cardiologia per peggioramento della dispnea.
La TC torace eseguita durante il ricovero ha mostrato un rapido aumento delle dimensioni dell’arteria polmonare (65 mm nel 2019, 76 mm nel 2021).
Alla coronarografia è stata evidenziata una compressione ab estrinseco del tronco comune, trattata mediante stent.
La procedura è stata ben tollerata e nessun nuovo sintomo clinico è stato riferito a 3 mesi di follow-up.
Case report
L’ipertensione polmonare è una patologia caratterizzata dalla presenza di elevate pressioni arteriose polmonari (PAP), con dilatazione e disfunzione ventricolare destra.
Riportiamo il caso di una donna di 47 anni con diagnosi di ipertensione arteriosa polmonare primaria nota dal 2018, diagnosticata mediante cateterismo cardiaco destro (pressione arteriosa polmonare sistolica, PAPs 107 mmHg; PAP media, PAPm 69 mmHg; PAP diastolica, PAPd 50 mmHg). Nello stesso 2018 durante il test del cammino di 6 minuti (6MWT) la paziente aveva riferito dispnea dopo 4 minuti per una performance di 380 m.
Inizialmente, era stata impostata una terapia con Macitentan e Sildenafil e l’anno successivo (2019), è stato introdotto il Selexipag visto il peggioramento della dispnea e della performance al 6MWT (320 m con dispnea a 3 minuti).
Nel gennaio 2021 si è presentata in PS per peggioramento della dispnea, con successivo ricovero in Cardiologia.
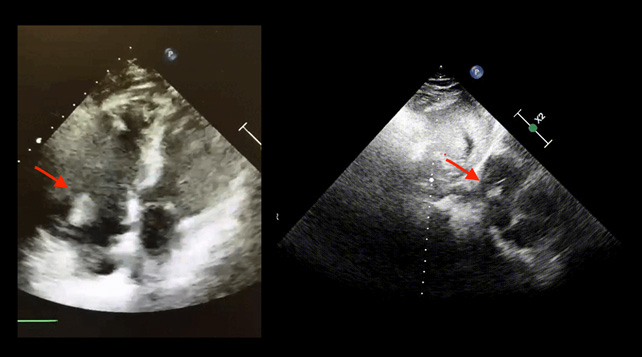
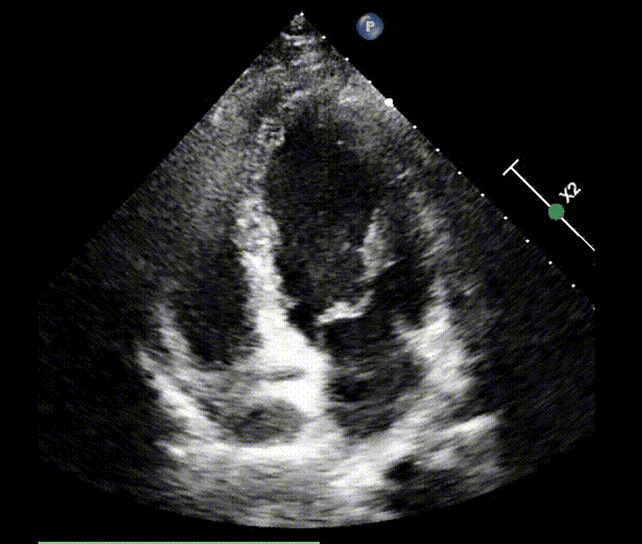
L’elettrocardiogramma ha mostrato ritmo sinusale, senza alterazioni patologiche significative. L’ecocardiogramma transtoracico (TTE) ha, invece, evidenziato una importante dilatazione ed ipocinesia del ventricolo destro (diametro basale 60 mm, TAPSE 16 mm) con PAPs stimata di 90 mmHg, minimo rigurgito tricuspidalico e moderato rigurgito polmonare. La frazione di eiezione ventricolare sinistra è risultata nella norma (60%) con movimento paradosso del setto interventricolare.
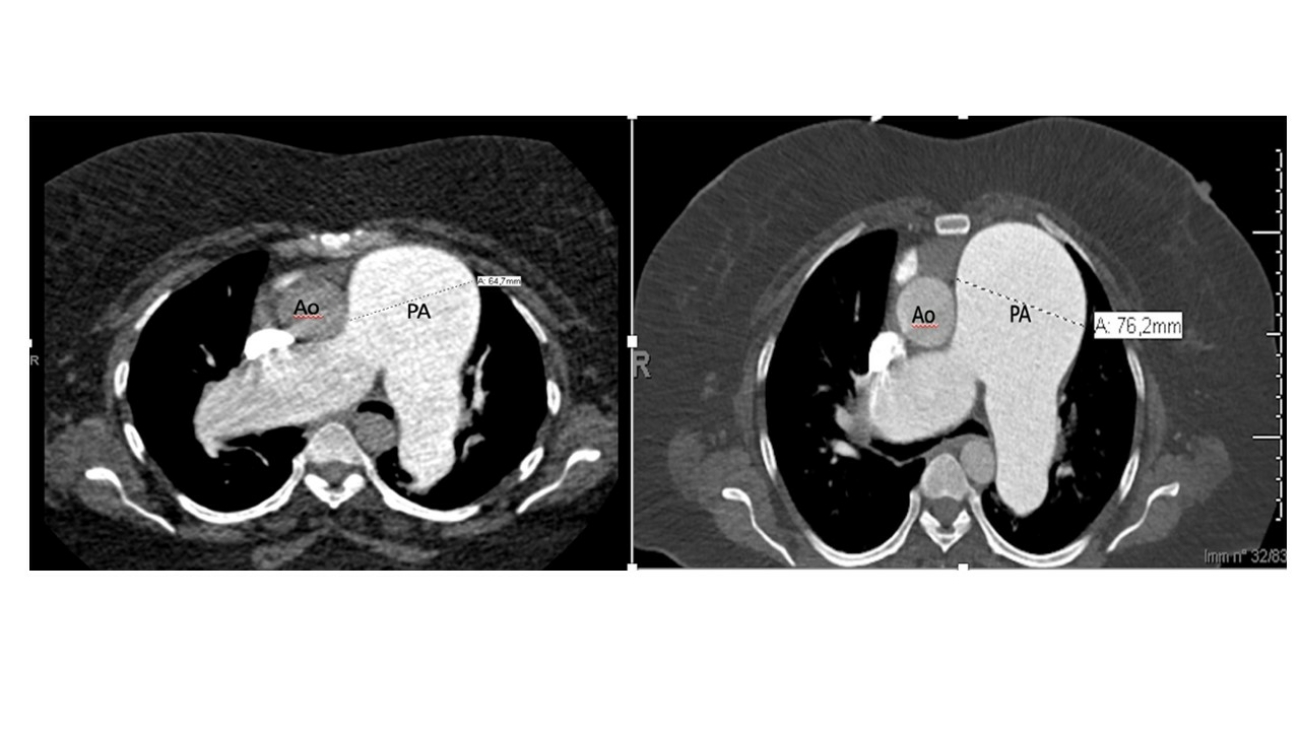
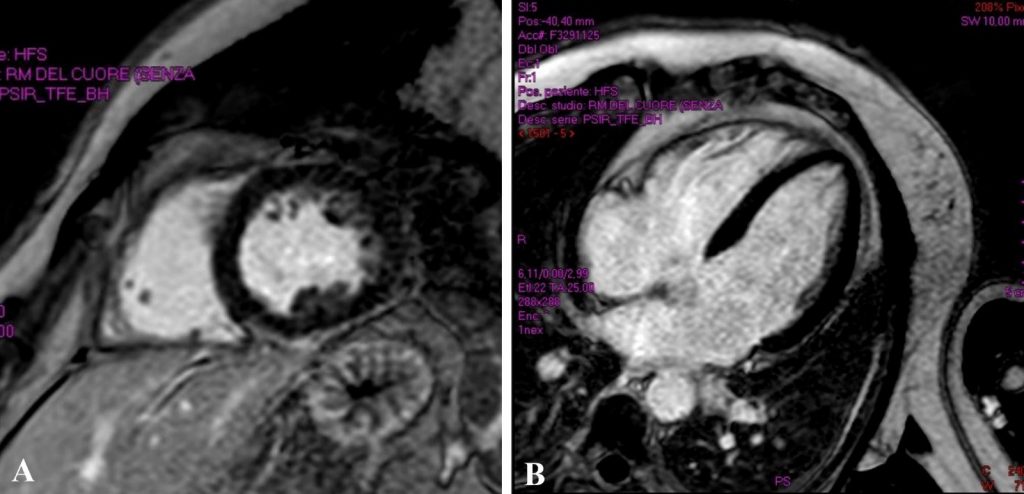
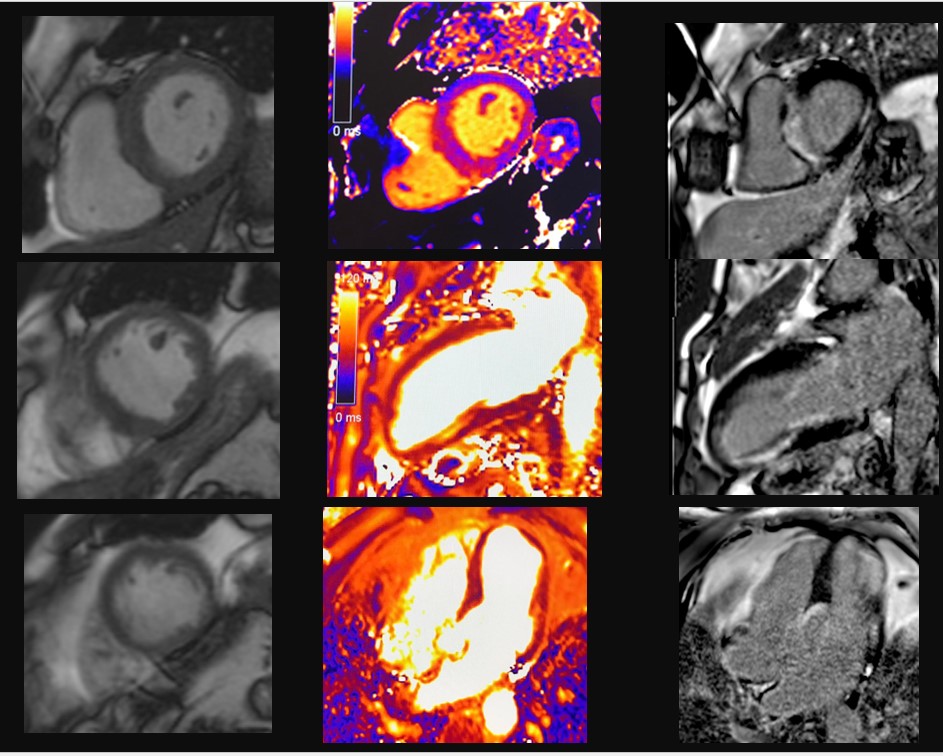
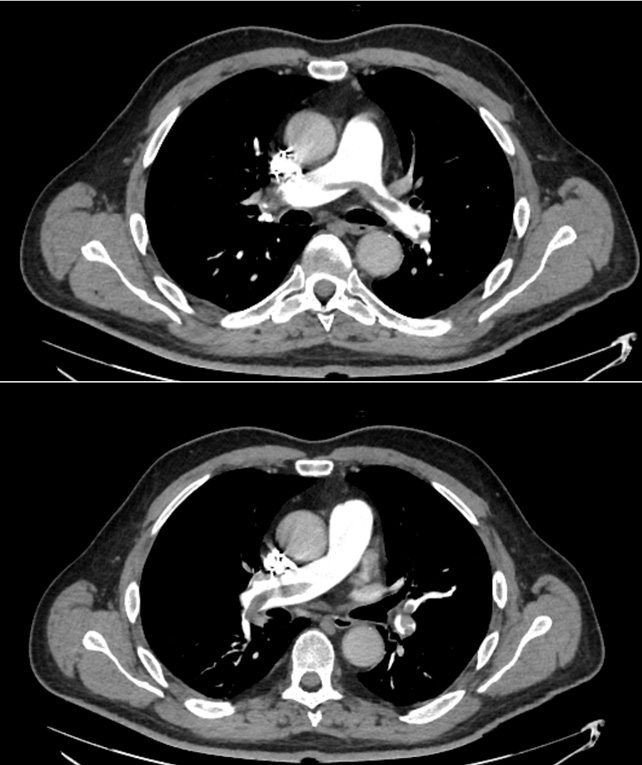
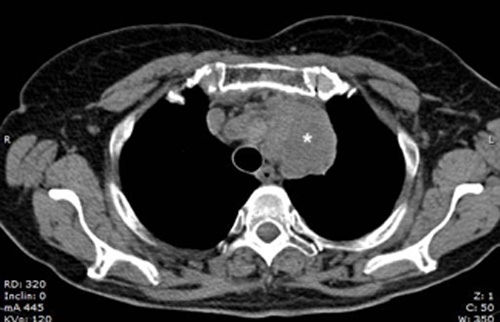
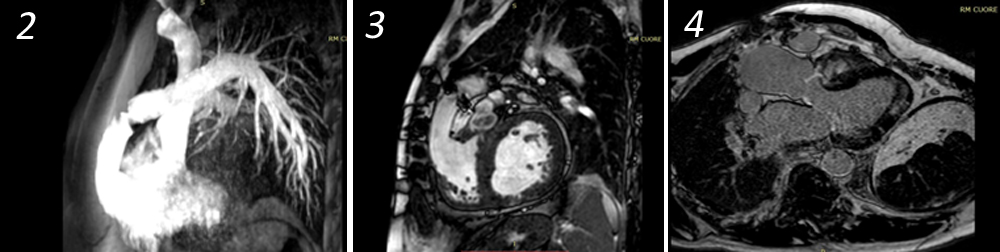
La TC eseguita ha escluso la presenza di embolia polmonare ma ha evidenziato una notevole dilatazione dell’arteria polmonare, in netto incremento rispetto al controllo precedente (65 mm nel 2019, 76 mm nel 2021), e dei suoi rami principali (50 mm contro 47 mm nel ramo destro, 42 mm contro 36 mm nel ramo sinistro) (Fig.1).
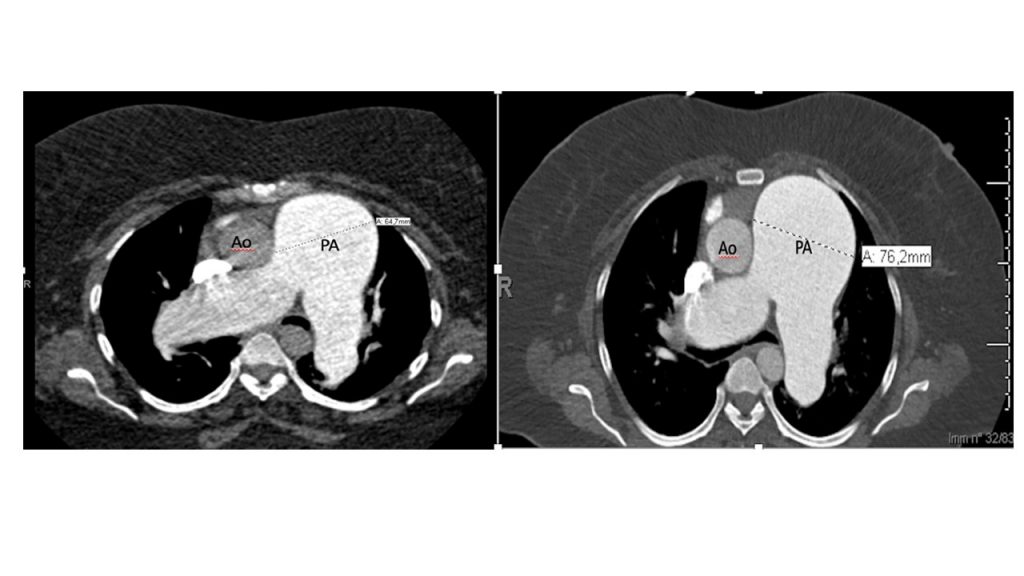
Fig 1: A sinistra: dimensioni TC dell’arteria polmonare nel 2019 (64,7 mm). A destra, dimensioni TC dell’arteria polmonare nel 2021 (76,2 mm).PA (Pulmonary artery), Ao (Aorta).
Durante il ricovero, è stato eseguito nuovamente il cateterismo cardiaco destro nel sospetto di peggioramento dell’ipertensione polmonare con evidenza di PAPs 120 mmHg e PAWP (pressione capillare polmonare) 100 mmHg.
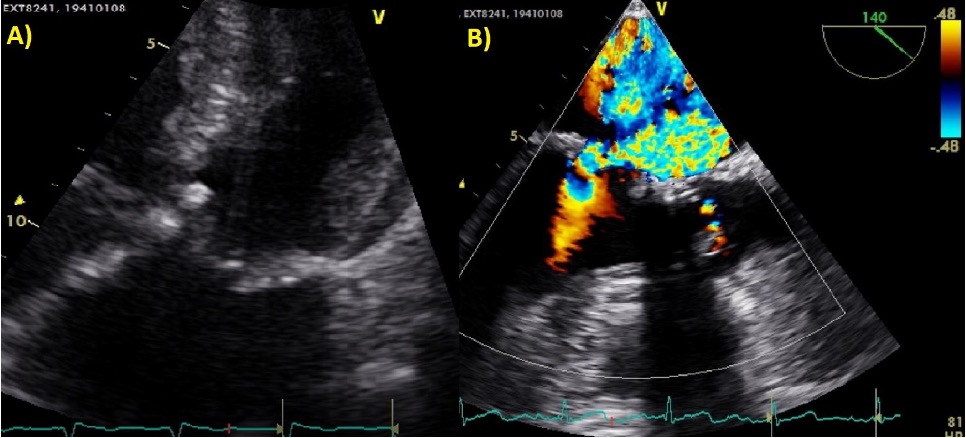
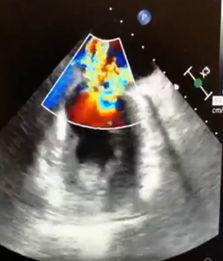
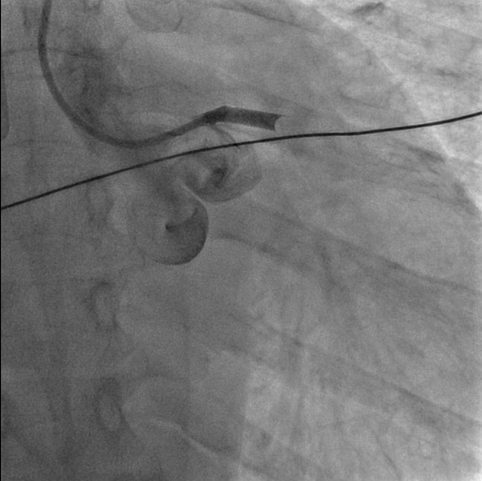
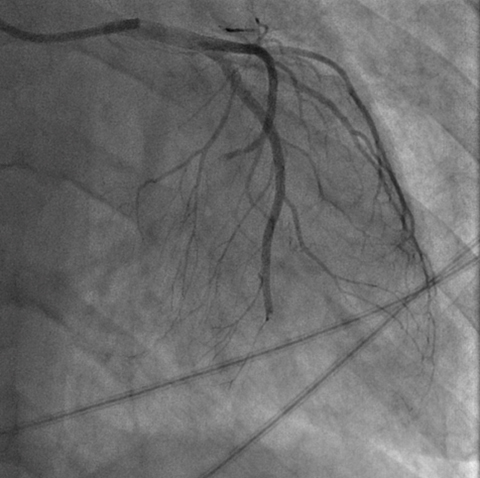
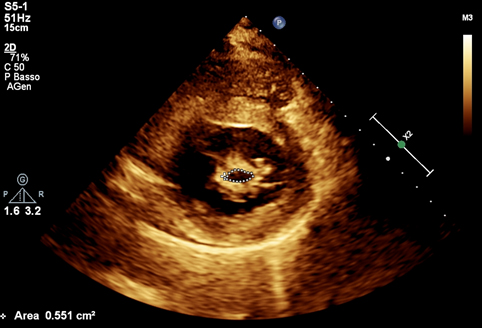
Nel sospetto di una compressione del tronco comune è stata posta indicazione ad angiografia coronarica, con effettivo riscontro di una compressione ab estrinseco del tronco comune dell’80% in assenza di placche ateromasiche. Il tronco comune è stato quindi valutato mediante ecografia intravascolare (IVUS), che ha confermato la presenza di un significativo restringimento luminale secondario alla compressione esterna. Considerando la significativa compressione esterna del tronco comune in una paziente con dispnea in peggioramento ed in assenza di dolore toracico o sincope, abbiamo deciso di eseguire un intervento coronarico percutaneo (PCI) con uno stent a rilascio di farmaco (DES) non protetto a livello del tronco comune con un buon risultato finale (Fig. 2). Non si sono verificate complicazioni durante e dopo la procedura e la paziente è stata dimessa dopo 48 ore in buone condizioni cliniche. Al follow-up a 3 mesi presso l’ambulatorio di ipertensione polmonare non ha riportato nessun nuovo sintomo.
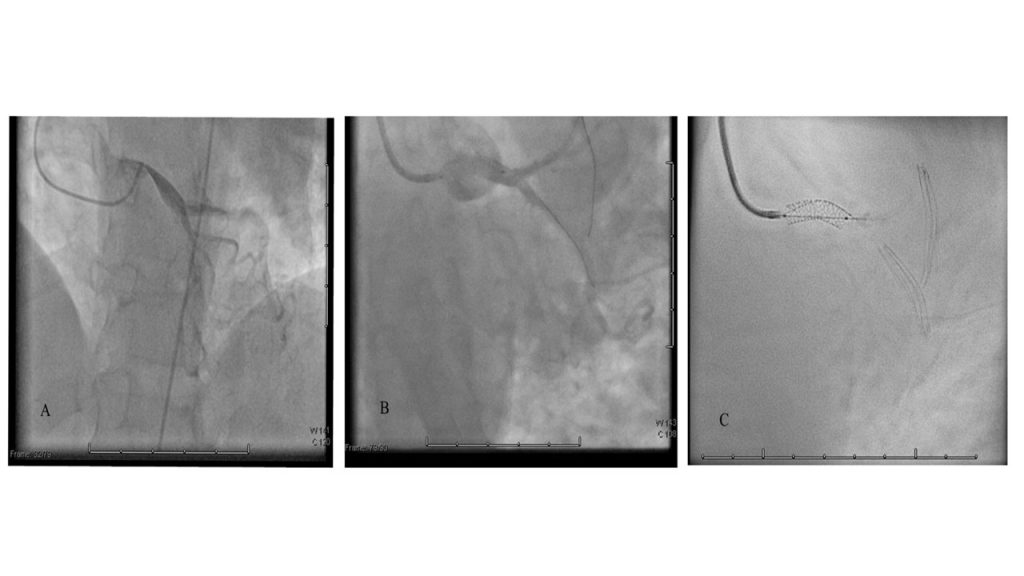
Fig. 2: A. Coronarografia con evidenza stenosi del tronco comune dovuta a compressione estrinseca. B-C: Percutaneous coronary intervention (PCI) with unprotect drug-eluting stent (DES) su tronco comune
Discussione
La paziente ha presentato un rapido aumento delle dimensioni dell’arteria polmonare con compressione ab estrinseco del tronco comune senza sintomi se non un peggioramento della dispnea. Pertanto, il trattamento con PCI con DES sul tronco comune è stato mirato non solo a prevenire ulteriori sintomi ma anche la morte improvvisa, considerando soprattutto la rapida dilatazione dell’arteria polmonare (11 mm in 16 mesi) in una paziente con terapia già ottimizzata per l’ipertensione polmonare.
Questa è stata la prima volta in cui nel nostro centro è stata trattata una compressione ab estrinseco del tronco comune mediante PCI con DES nonostante l’assenza di angina o perdita di coscienza.
Secondo la letteratura, l’ipertensione arteriosa polmonare (PAH) è responsabile della compressione del tronco comune nel 5-19% dei pazienti, specialmente in quelli con PAH [1-2]. Il meccanismo è dovuto alla dilatazione della arteria polmonare. Tuttavia, la compressione del tronco comune dovuto alla dilazione dell’arteria polmonare è più spesso associata a cardiopatie congenite, in particolare ad un difetto del setto interatriale, del setto ventricolare, al dotto arterioso pervio o alla tetralogia di Fallot. L’ischemia miocardica significativa che consegue la compressione del tronco comune dipende sia dal grado di compressione del vaso stesso che dall’angolo che forma con il seno sinistro di Valsalva (soprattutto se inferiore a 30°). Anche il rapporto tra arteria polmonare e aorta superiore o uguale a 2 è considerato un fattore di rischio addizionale per la compressione del tronco comune [3-5]. Galiè et al [6] hanno dimostrato che un diametro dell’arteria polmonare di almeno 40 mm rappresenta il miglior predittore di stenosi del tronco comune del 50% o superiore.
Ad oggi, vi è una scarsità di protocolli per la gestione della compressione del tronco comune nell’ambito della PAH. Il bypass aortocoronarico e l’impianto di stent non protetto sono le uniche strategie attualmente utilizzate. Data l’elevata mortalità chirurgica nei pazienti con PAH, lo stent è, in genere, preferito come strategia di rivascolarizzazione di scelta e diversi autori hanno riportato risultati positivi in questo tipo di pazienti [7].
Conclusione
Nel caso descritto, dato il rapido aumento di dimensioni dell’arteria polmonare in paziente con nota ipertensione polmonare, la compressione ab estrinseco del tronco comune è stata trattata mediante stent per prevenire gli eventi avversi, in accordo con la letteratura.
Sarà necessario nei prossimi anni implementare un algoritmo di screening per valutare la progressione della dilatazione dell’arteria al fine di offrire un tempestivo trattamento per evitare la compressione del tronco comune, indipendentemente dai sintomi[8].
REFERENCES
- Kothari SS, Chatterjee SS, Sharma S, Rajani M, Wasir HS. Left main coronary artery compression by dilated main pulmonary artery in atrial septal defect. Indian Heart J 46: 165-167, 1994.
- Mesquita SM, Castro CR, Ikari NM, Oliveira SA, Lopes AA. Likelihood of left main coronary artery compression based on pulmonary trunk diameter in patients with pulmonary hypertension. Am J Med 116: 369-374, 2004.
- Lee MS, Oyama J, Bhatia R, Kim YH, Park SJ. Left main coronary artery compression from pulmonary artery enlargement due to pulmonary hypertension: a contemporary review and argument for percutaneous revascularization. Catheter Cardiovasc Interv 76: 543-550, 2010.
- Doyen D, Moceri P, Moschietto S, et al. Left main coronary artery compression associated with primary pulmonary hypertension. J Am Coll Cardiol. 2012; 60: 559.
- Dodd JD, Maree A, Palacios I, de Moor MM, Mooyaart EA, Shapiro MD, Ferencik M, Brady T, Abbara S, Cury RC, Hoffmann U. Images in cardiovascular medicine. Left main coronary artery compression syndrome: evaluation with 64-slice cardiac multidetector computed tomography. Circulation. 2007 Jan 2;115(1):e7-8. doi: 10.1161/CIRCULATIONAHA.106.645622. PMID: 17200448.
- Galiè N, Saia F, Palazzini M, Manes A, Russo V, Bacchi Reggiani ML, Dall’Ara G, Monti E, Dardi F, Albini A, Rinaldi A, Gotti E, Taglieri N, Marrozzini C, Lovato L, Zompatori M, Marzocchi A. Left Main Coronary Artery Compression in Patients With Pulmonary Arterial Hypertension and Angina. J Am Coll Cardiol. 2017 Jun 13;69(23):2808-2817. doi: 10.1016/j.jacc.2017.03.597. PMID: 28595696.Ogiso M, Serizawa N, Kamishima K, Yamaguchi J, Hagiwara N. Percutaneous coronary intervention for left main compression syndrome due to severe idiopathic pulmonary arterial hypertension: one year follow-up using intravascular imaging. Intern Med. 2015;54(7):801-4.
- Fujiwara K, Naito Y, Higashiue S, Takagaki Y, Goto Y, Okamoto M, Yoshida S, Sekii H, Tomobuchi Y. Left main coronary trunk compression by dilated main pulmonary artery in atrial septal defect. Report of three cases. J Thorac Cardiovasc Surg. 1992; 104:449–452.
- Labin JE, Saggar R, Yang EH, Lluri G, Sayah D, Channick R, Ardehali A, Aksoy O, Parikh RV. Left main coronary artery compression in pulmonary hypertension. Catheter Cardiovasc Interv. 2020 Nov 25. doi: 10.1002/ccd.29401. Epub ahead of print. PMID: 33241630.