Gaetano Bernardini, Marco Dell’Uomo; Stefano Sforna; Leoluca Nicolì, Gianfranco Notarianni
Scuola di Specializzazione in Malattie dell’Apparato Cardiovascolare, Università degli Studi di Perugia.
ABSTRACT
Un uomo di 59 anni accedeva in Pronto Soccorso per segni e sintomi di scompenso cardiaco congestizio. L’ecocardiogramma all’ingresso mostrava un quadro di cardiomiopatia restrittiva con aspetto delle pareti a vetro smerigliato, altamente sospetto per amiloidosi cardiaca. Pertanto, il paziente è stato sottoposto a scintigrafia con marcatori ossei e screening ematologico che mostrava una componente monoclonale all’elettroforesi, poi caratterizzata come Ig di tipo Lambda. La biopsia osteomidollare evidenziava discrasia plasmacellulare. La biopsia miocardica è risultata positiva alla colorazione Rosso Congo e successivamente all’analisi immunoistochimica per amiloidosi AL. Veniva iniziata chemioterapia con Bortezomib, Melphalan e Desametasone. Il quadro clinico del paziente è rapidamente peggiorato con insufficienza epatica ed insufficienza renale pre-renale fino all’exitus. L’evoluzione a carattere fulminante del caso verso l’exitus sottolinea l’importanza di una diagnosi tempestiva.
CASE REPORT
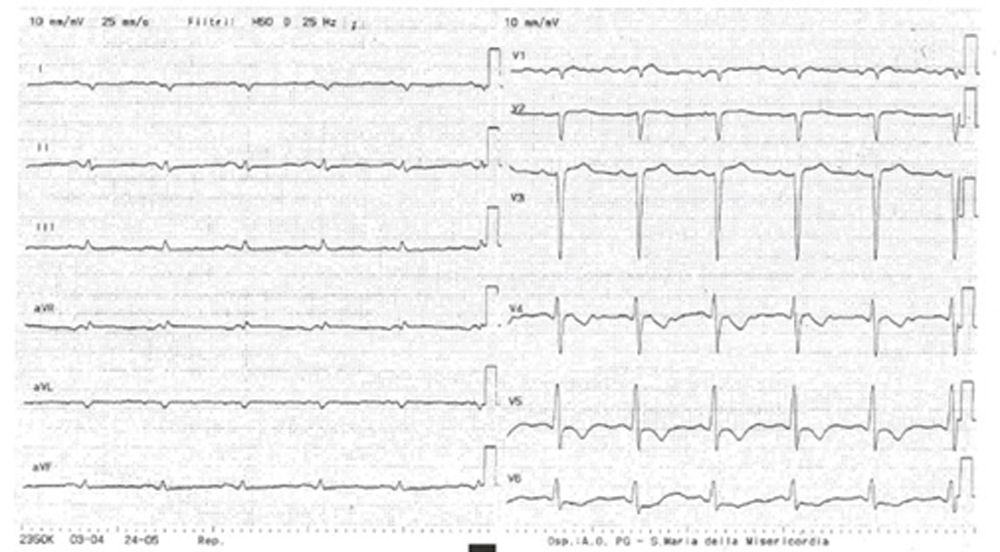
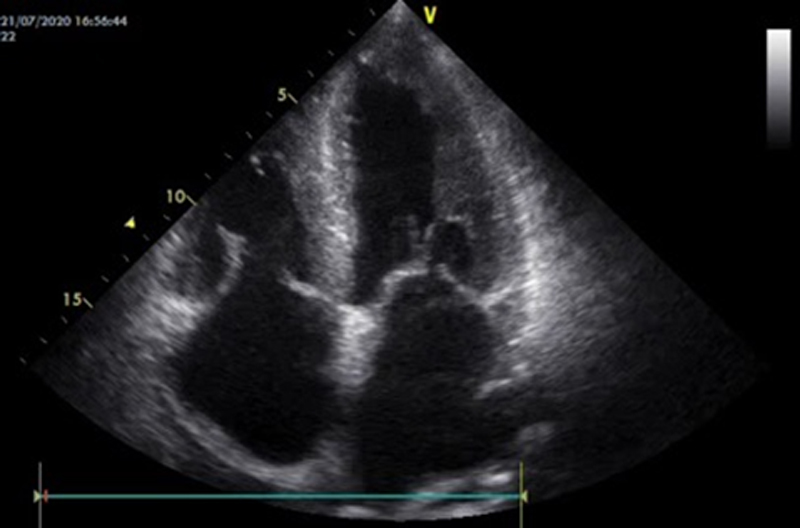
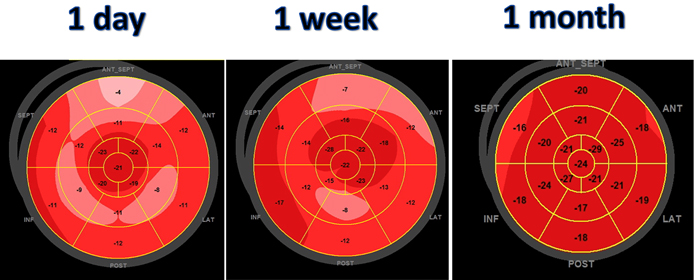
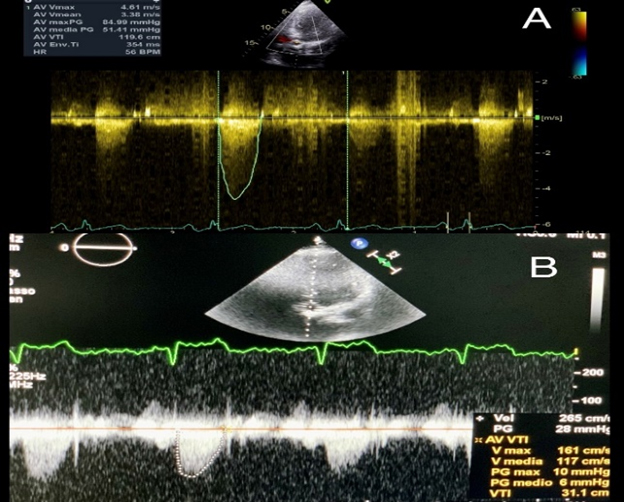
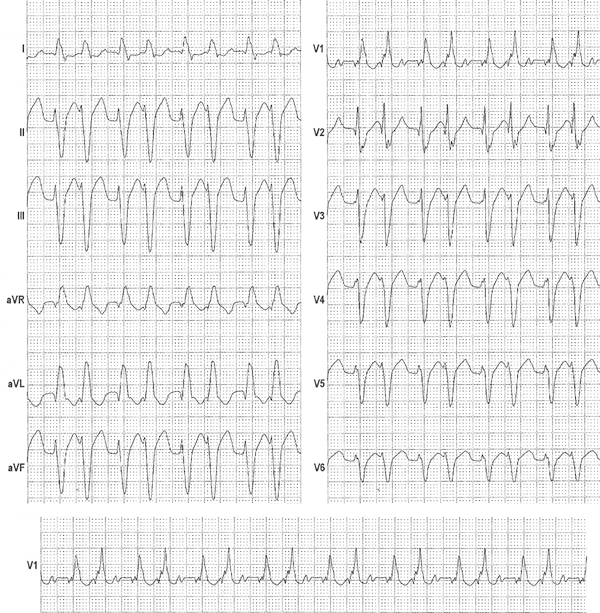
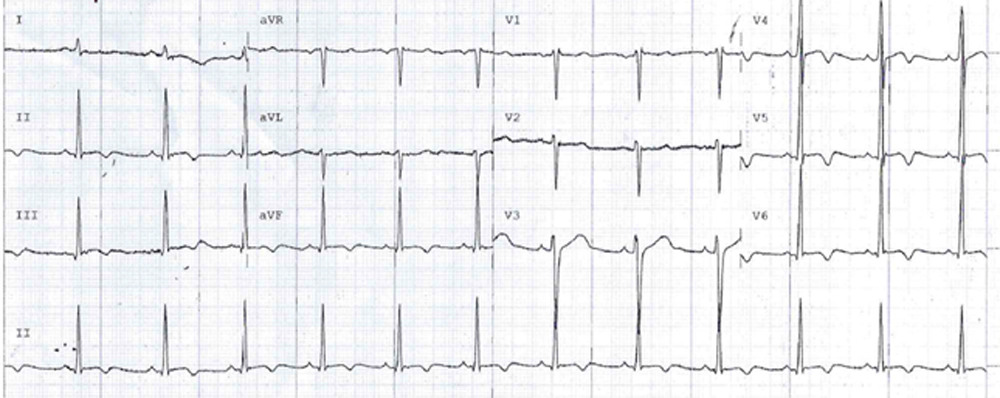
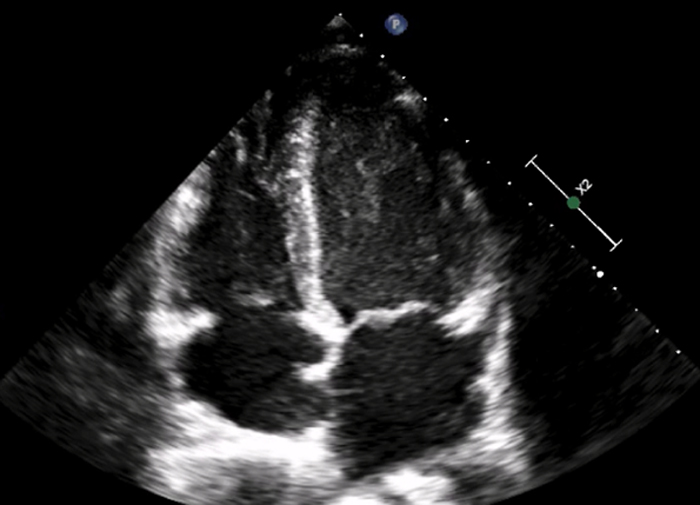
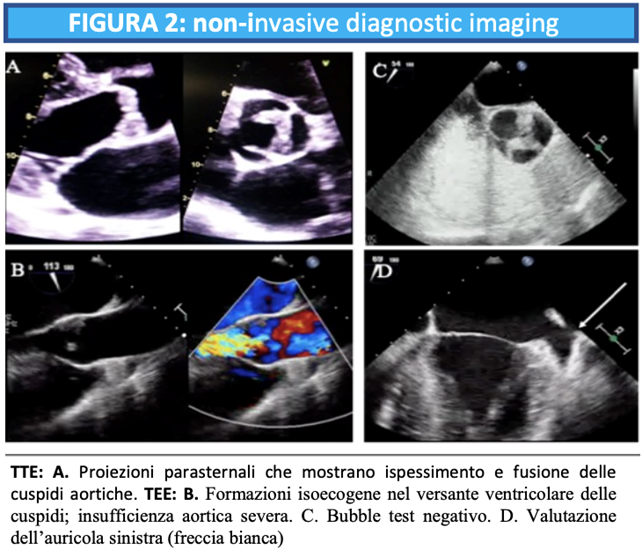
Un uomo di 59 anni accede al Pronto Soccorso Cardiologico per dispnea progressivamente ingravescente da 4-5 mesi associata ad ortopnea e a episodi di dispnea parossistica notturna. L’anamnesi patologica risultava positiva per ipertensione arteriosa sistemica ed ectasia dell’aorta ascendente in follow up. All’esame obiettivo il paziente risultava ortopnoico, tachicardico con normali valori di pressione arteriosa e di SatO2 (PA 110/80 mmHg, FC 105/min e SatO2 96% in aa). Si rilevavano inoltre all’auscultazione cardiaca un 3° tono, al torace crepitazioni bibasali con ipofonesi in sede medio-basale destra ed edemi declivi bilaterali improntabili fino al ginocchio. Pertanto, si predisponeva il ricovero presso il reparto di Cardiologia e Fisiopatologia Cardiovascolare. Gli esami di laboratorio all’ingresso mostravano un incremento della troponina ultrasensibile (TnHS) (348 ng/L) e del peptide natriuretico di tipo B (NTproBNP) (13140 pg/ml). I restanti valori di laboratorio come emocromo, funzione renale ed epatica risultavano nella norma. L’ECG all’ingresso mostrava un ritmo sinusale (RS) con bassi voltaggi nelle derivazioni periferiche e alterazioni della ripolarizzazione come da sovraccarico del ventricolo sinistro. L’ecocardiogramma all’ingresso mostrava ipertrofia ventricolare severa (SIV 19 mm) con aspetto delle pareti a vetro smerigliato come da patologia infiltrativa, una cinesi globale lievemente ridotta (FE 45%) ed un pattern diastolico restrittivo (E/E’ 21,5), indicativo di elevate pressioni di riempimento del ventricolo sinistro.
Dato l’elevato sospetto di amiloidosi cardiaca, il paziente è stato sottoposto ad una scintigrafia con marcatori ossei e screening ematologico. Lo screening ematologico mostrava la presenza di una componente monoclonale all’elettroforesi, poi caratterizzata all’immunofissazione come Ig di tipo Lambda (2,3 g/L) con un rapporto K/Lambda di 0,36. Collateralmente è stata eseguita una biopsia del grasso periombelicale risultata poi negativa per colorazione al Rosso Congo e una biopsia osteo-midollare (BOM). Durante il ricovero è stata effettuata terapia diuretica per via endovenosa fino al ripristino dello stato di euvolemia e del compenso di circolo. Il paziente è stato dunque dimesso in attesa di eseguire RMN cardiaca e di referto della BOM eseguita durante la degenza. Il valore di NTproBNP alla dimissione era di 17800 pg/ml.
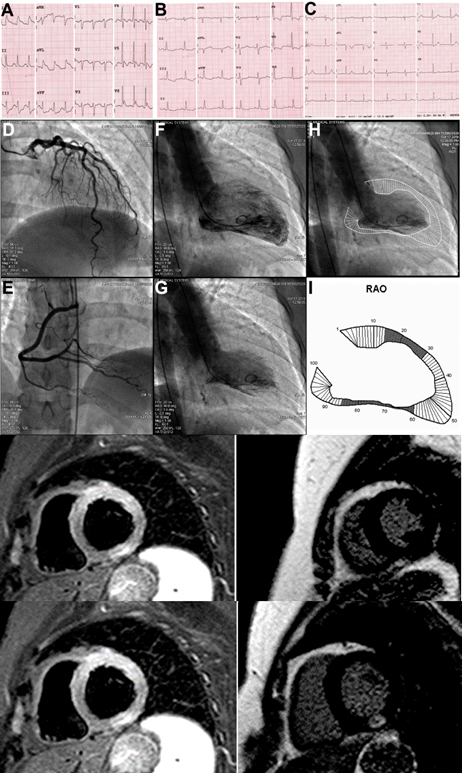
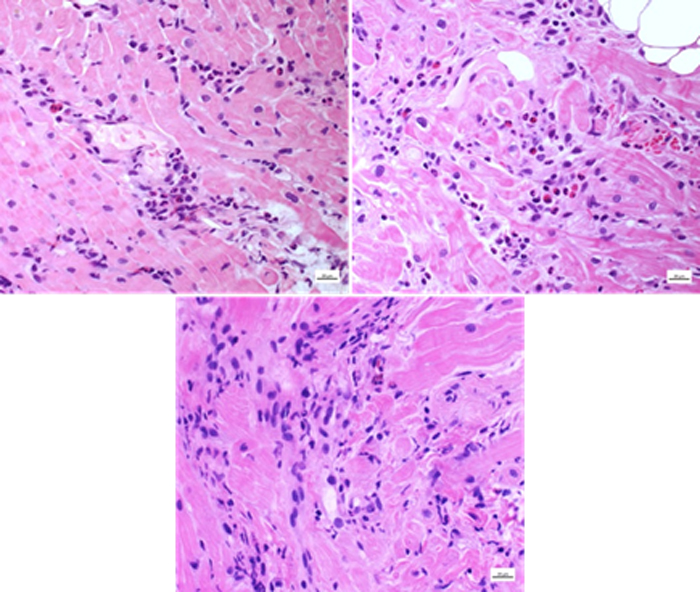
Dopo circa una settimana dalla dimissione, il paziente giungeva nuovamente a ricovero per dispnea, segni di scompenso cardiaco congestizio (SCC) e sindrome da bassa portata. L’ecocardiografia mostrava un severo peggioramento della funzione sistolica del ventricolo sinistro (FE 30%). In considerazione del referto della BOM eseguita nel contesto del primo ricovero che evidenziava la presenza di discrasia plasmacellulare, veniva eseguita una RMN cardiaca. La RMN cardiaca mostrava un quadro di cardiomiopatia restrittiva con pattern di distribuzione del late gadolinium enhancement (LGE) compatibile con patologia infiltrativa. Veniva eseguita inoltre una biopsia miocardica, risultata positiva alla colorazione Rosso Congo. Il campione è stato poi inviato presso il Dipartimento di Anatomia Patologica di Padova per l’esecuzione dell’indagine immunoistochimica. A completamento dell’iter diagnostico veniva eseguito esame coronarografico che mostrava vasi coronarici esenti da lesioni significative. Nel corso del ricovero è stata eseguita terapia diuretica endovenosa e terapia di supporto al circolo con inotropi (dobutamina) e Levosimendan. Il paziente è stato dimesso in compenso clinico e con valore di NTproBNP alla dimissione 18740 pg/ml.
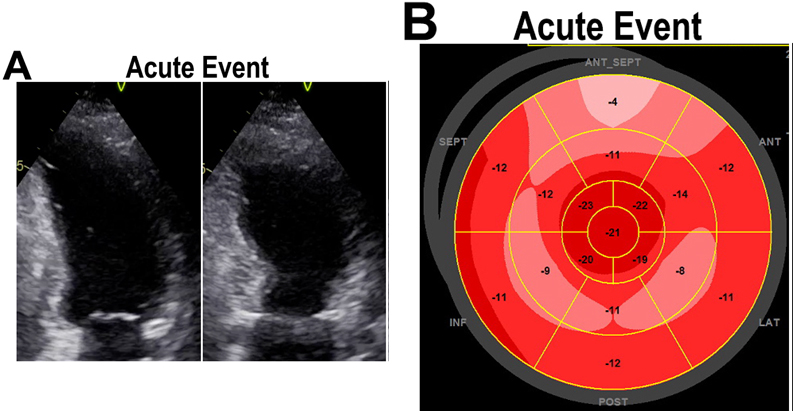
A distanza di 6 giorni dalla dimissione il paziente giungeva nuovamente a ricovero per peggioramento dei segni e sintomi SCC e sindrome da bassa portata. Gli esami ematici eseguiti all’ingresso mostravano microalbuminuria positiva (29 mg/dL), GOT 56 UI/l; GPT 51 UI/l; Bilirubina tot 3.09 mg/dl, NTproBNP 31140 pg/ml; TroponinaHS 657 ng/L. L’ecocardiografia eseguita all’ingresso mostrava un ulteriore peggioramento della funzione sistolica del ventricolo sinistro (FE 20%). Lo stato emodinamico compromesso del paziente ha richiesto l’utilizzo di furosemide in infusione ad elevati dosaggi, di supporto inotropo con dobutamina (5 gamma/kg/min) e vasopressorio con noradrenalina a dosaggio crescente. In considerazione della gravità del quadro clinico del paziente, il caso veniva nuovamente discusso con i Colleghi Ematologi e si decideva di iniziare chemioterapia con Bortezomib, Melphalan e desametasone, seppur ancora in attesa del referto dell’esame immunoistochimico. Gli esami ematici eseguiti in regime di ricovero dimostravano un costante incremento delle catene leggere lambda (600 mg/dl). A distanza di pochi giorni dall’inizio della terapia, il referto dell’esame immunoistochimico (Anatomia Patologica di Padova) confermava il sospetto diagnostico di amiloidosi AL.
In considerazione delle gravi condizioni cliniche generali si contattava e inviava relazione presso Centro Trapianti di Centro di Riferimento per valutare possibilità di trapianto cardiaco seguito da autotrapianto di midollo osseo. Tale ipotesi è stata giudicata non percorribile a cause dello scadimento delle condizioni cliniche del paziente.
Il quadro clinico del paziente è rapidamente peggiorato con insufficienza epatica a genesi mista (stasi, tossicità da chemioterapici, ipoperfusione) ed insufficienza renale pre-renale fino all’exitus.
Il carattere rapidamente evolutivo dell’amiloidosi nel nostro caso sottolinea l’importanza di una diagnosi tempestiva tale da favorire un approccio terapeutico multidisciplinare. Il ruolo dell’ecocardiografia nel favorire una diagnosi precoce risulta essenziale; l’identificazione della marcata ipertrofia ventricolare con aspetto a vetro smerigliato e di una disfunzione diastolica severa, consente di porre il sospetto clinico così da avviare nel più breve tempo possibile il work up diagnostico.