Francesco Cannata1,2, Mauro Chiarito1,2, Giuseppe Pinto1,2, Alessandro Villaschi1,2, Jorge Sanz-Sánchez3,4, Fabio Fazzari2, Damiano Regazzoli2, Antonio Mangieri2, Renato M Bragato2, Antonio Colombo2, Bernhard Reimers2, Gianluigi Condorelli1,2, Giulio G Stefanini1,2
1 Department of Biomedical Sciences, Humanitas University, Via Rita Levi Montalcini, 4, Pieve Emanuele-Milan, Italy.
2 IRCCS Humanitas Research Hospital, Rozzano-Milan, Italy.
3 Hospital Universitario y Politecnico La Fe, Valencia, Spain.
4 Centro de Investigación Biomedica en Red (CIBERCV), Madrid, Spain
ABSTRACT
Lo studio ha valutato i dati presenti in letteratura riguardo ad efficacia e sicurezza della procedura di TAVI nei pazienti con stenosi aortica ed amiloidosi cardiaca, nei quali l’utilità della procedura è stata messa in dubbio. Tramite metanalisi di sette studi osservazionali, è stato dimostrato che il rischio di mortalità è minore nei pazienti sottoposti a TAVI, rispetto ad un approccio di sola terapia medica (OR 0.23, 95%CI 0.07-0.73, P=0.001), E con un profilo di sicurezza comparabile a quello della TAVI nei pazienti senza amiloidosi cardiaca, fatta eccezione per un aumentato rischio di impianto di Pacemaker (OR 1.76, 95%CU 0.91-4.09, p=0.085).
COMMENTO
La presente metanalisi, già premiata come uno dei migliori abstract presentati al congresso della Società Italiana di Cardiologia 2021 e successivamente pubblicata a giugno 2022 su ESC Heart Failure, valuta l’impatto della procedura di TAVI nei pazienti con stenosi aortica severa e amiloidosi cardiaca (CA-AS).(1)
Fino al 16% dei pazienti candidati a TAVI può presentare un quadro di cardiopatia infiltrativa secondaria a deposito di amiloide.(2) L’associazione delle due patologie comporta una peggiore capacità funzionale e un’aumentata mortalità rispetto ai pazienti con stenosi aortica isolata; nonostante ciò l’impatto prognostico della TAVI in questa popolazione è stato in passato dibattuto.
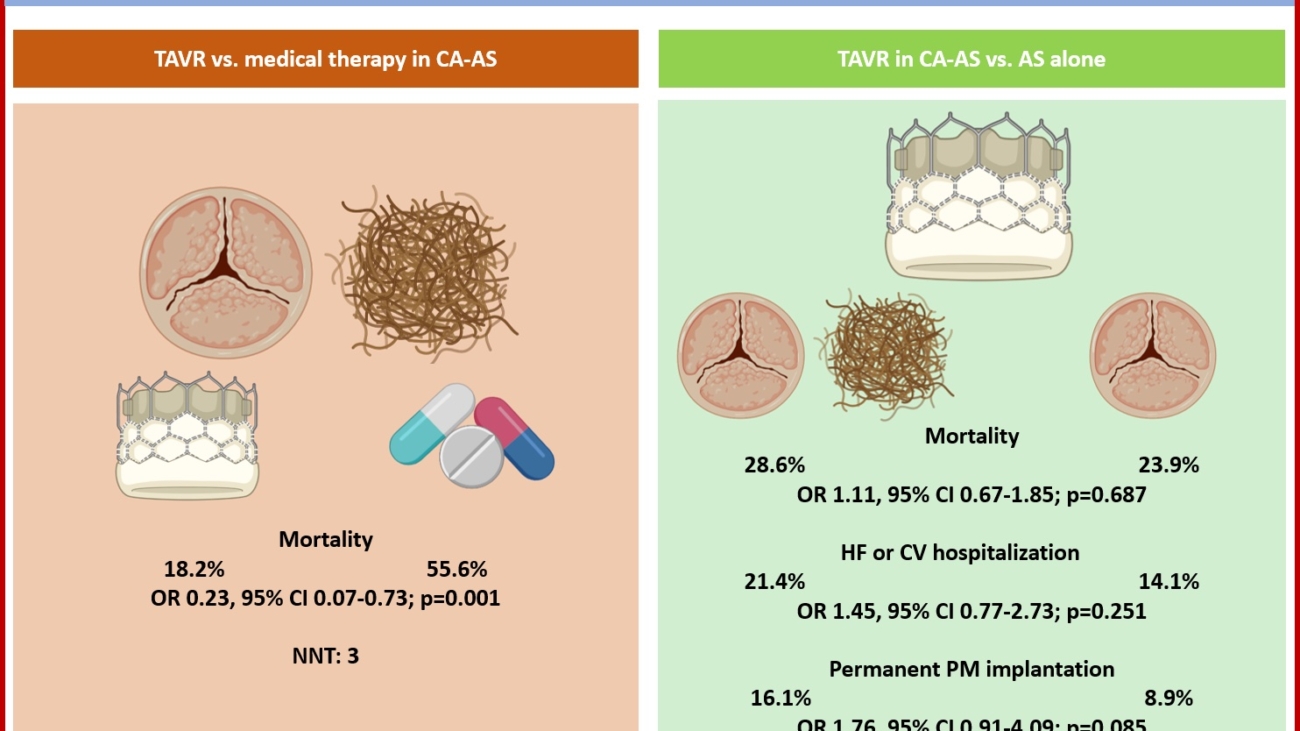
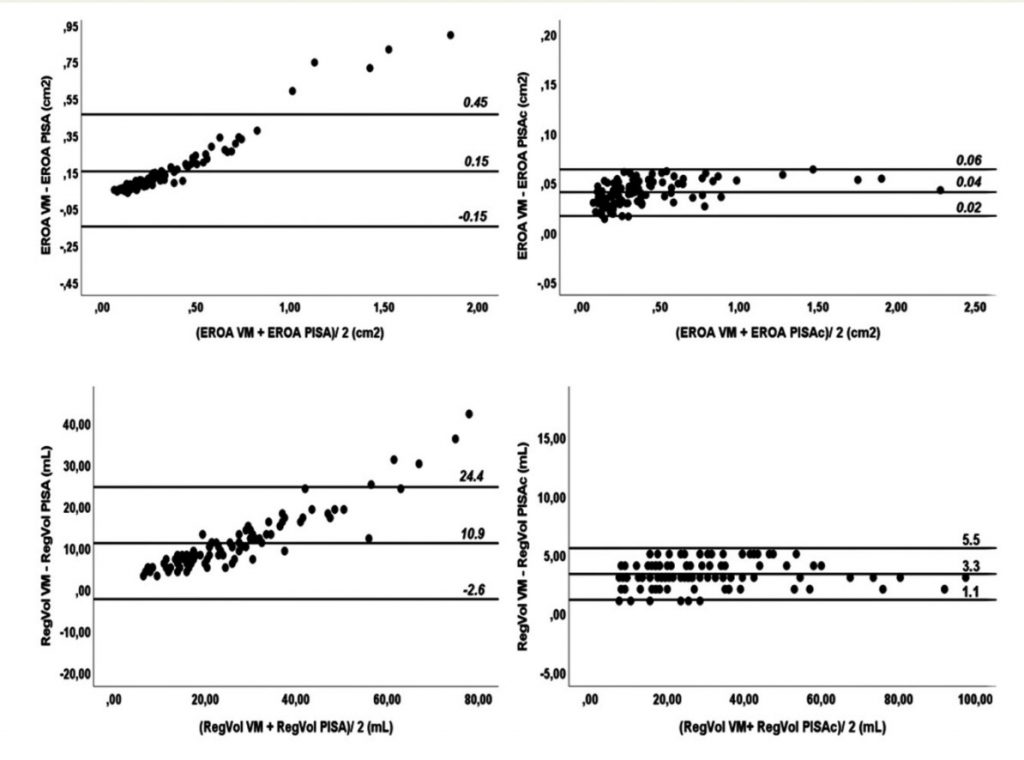
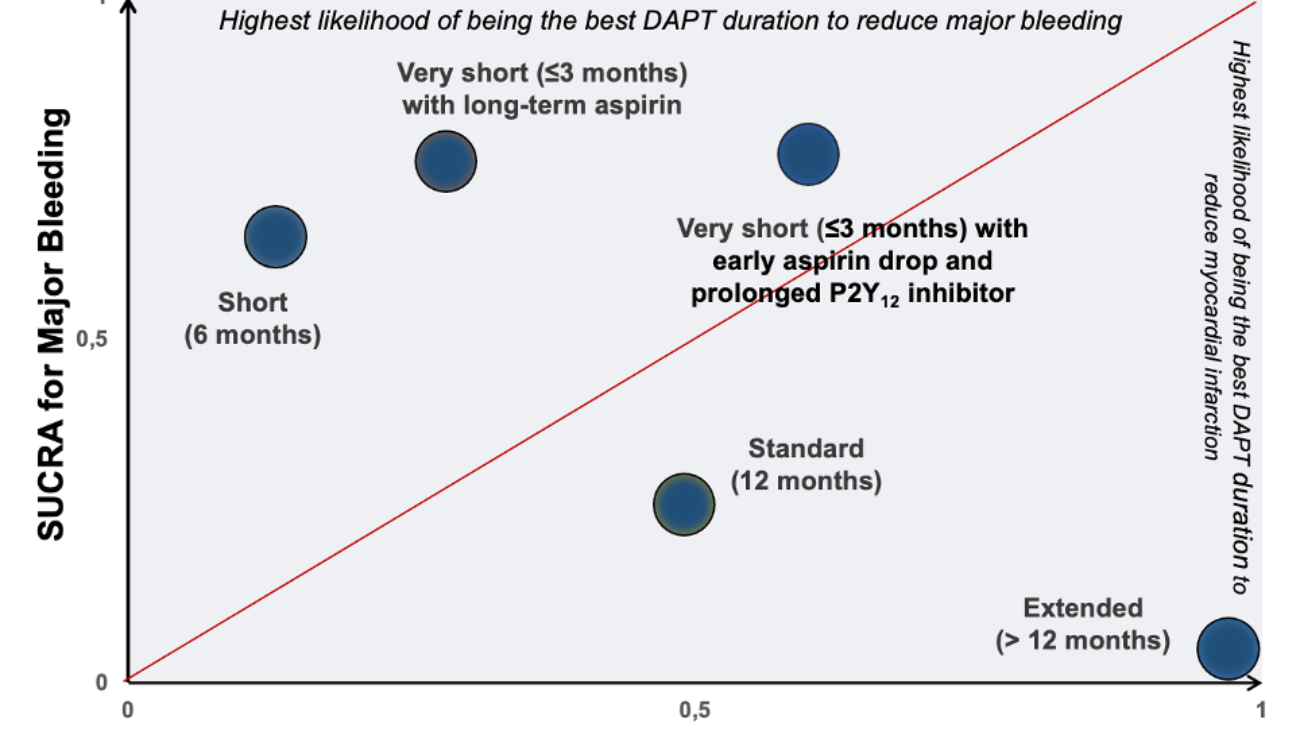
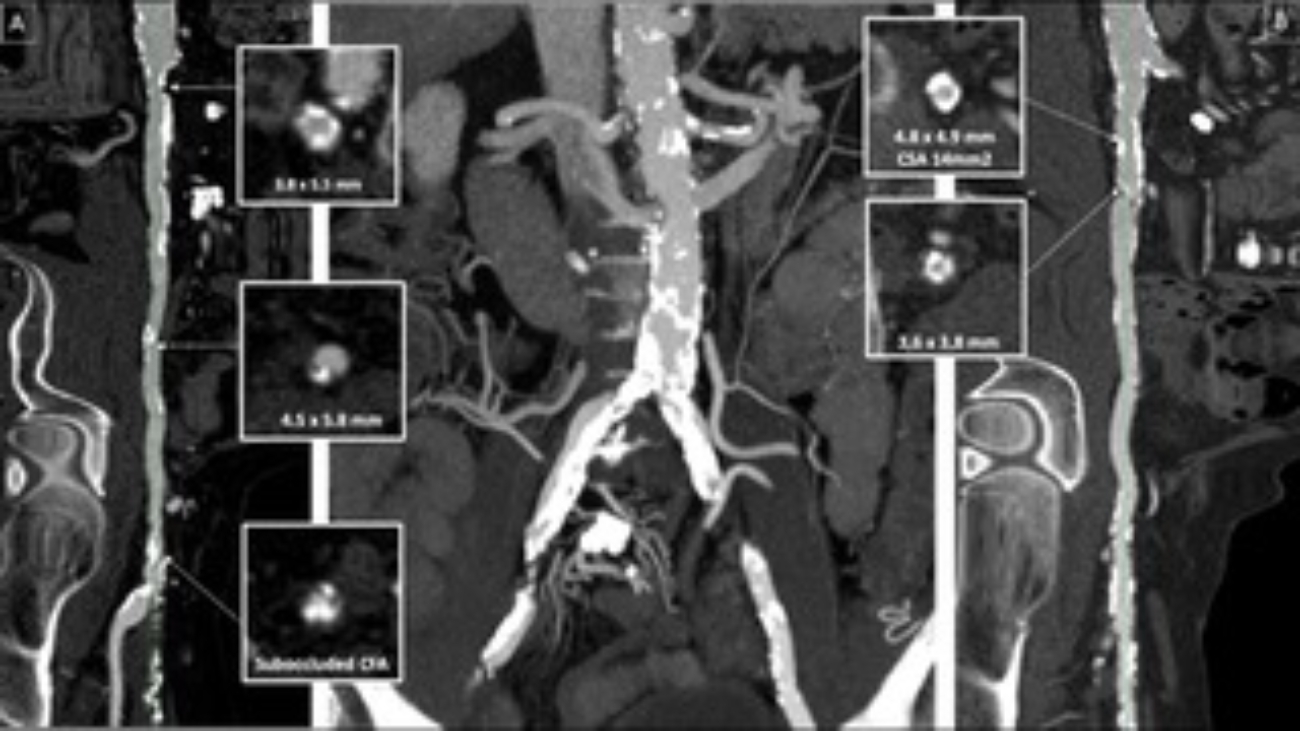
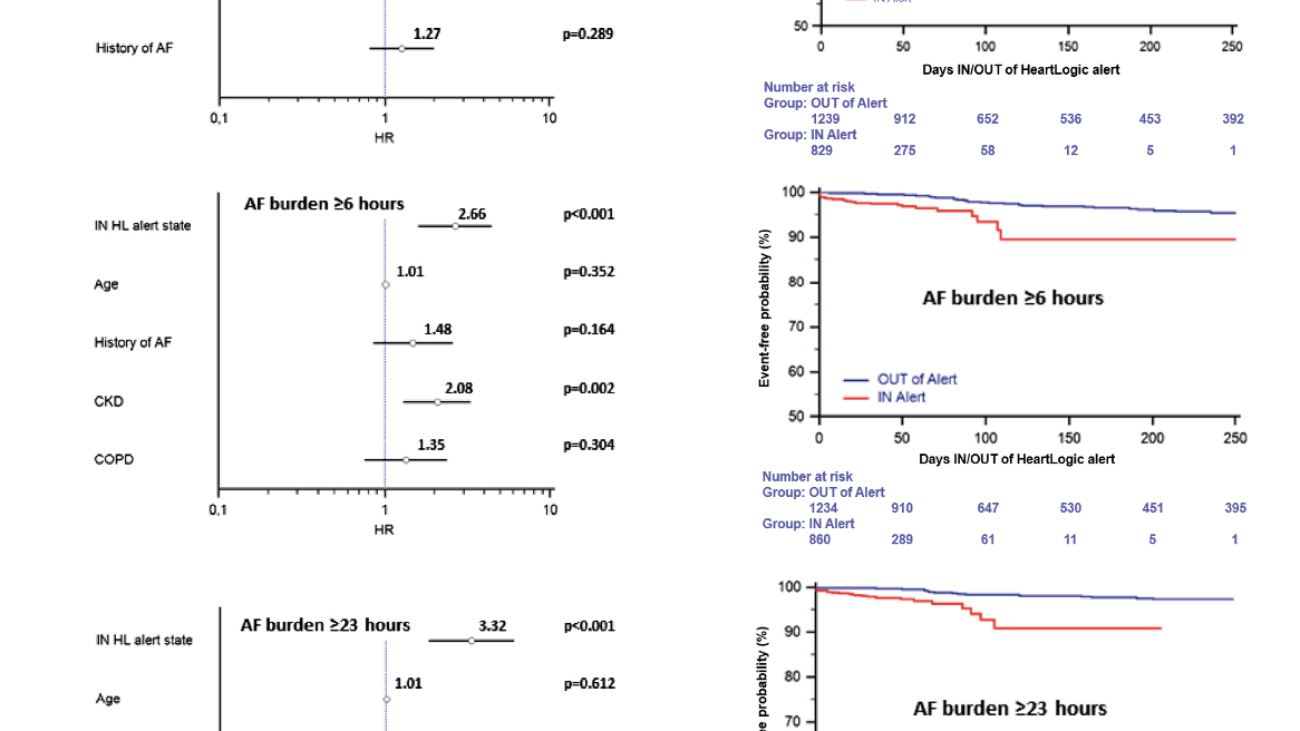
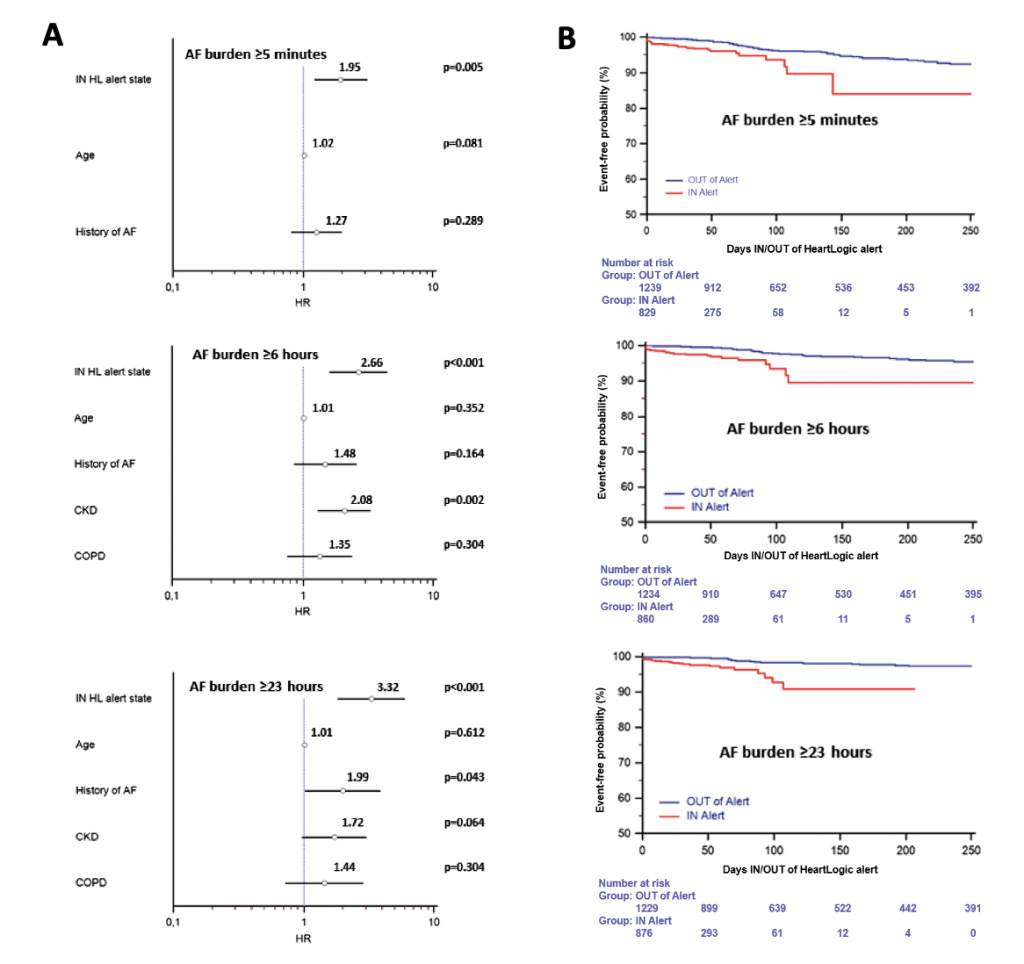
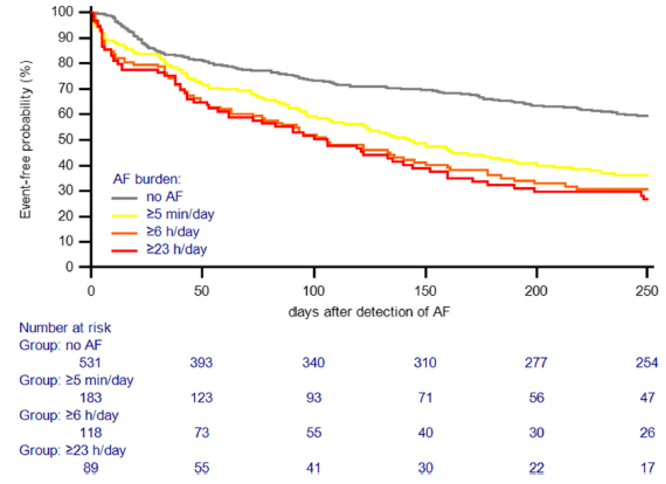
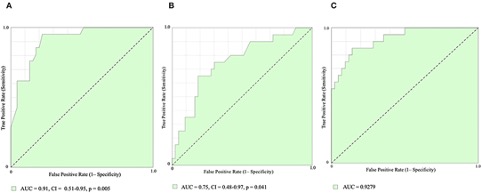
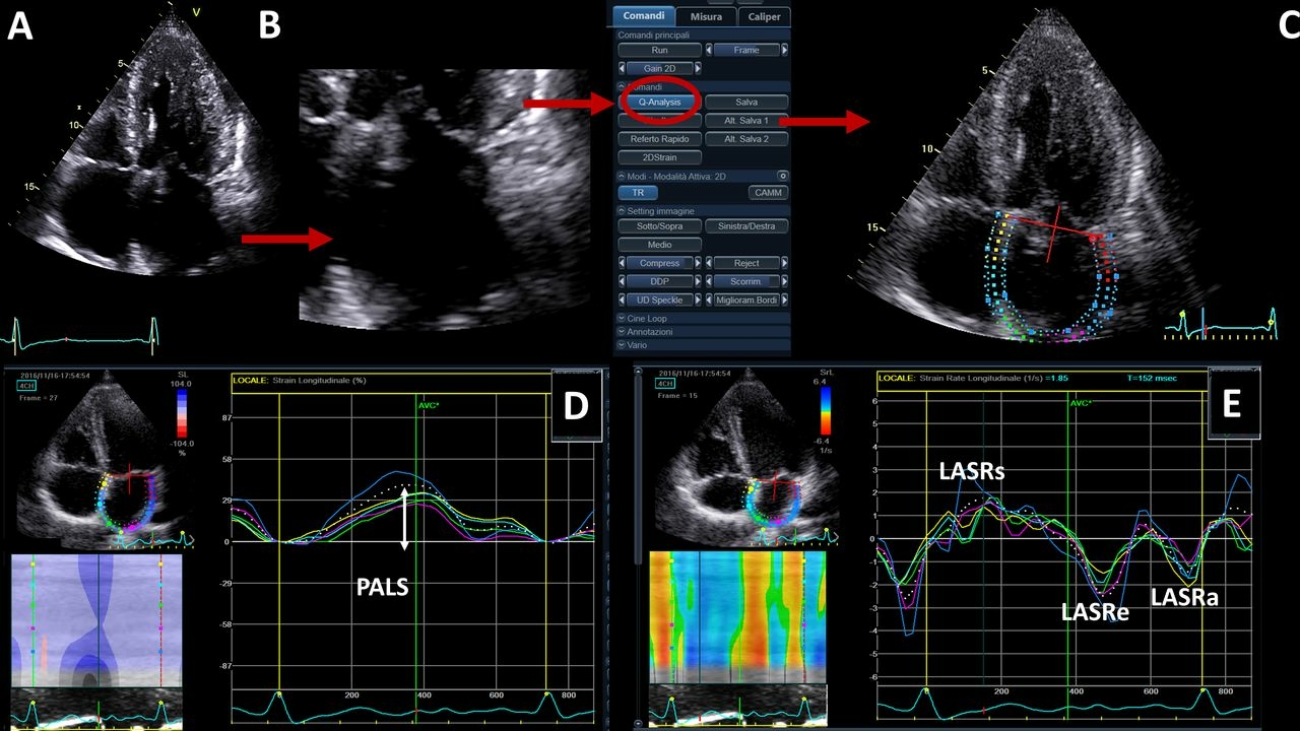
Tramite revisione sistematica ed analisi metanalitica, è stato possibile identificare 7 studi osservazionali: 3 lavori riportavano dati riguardanti la mortalità dei pazienti con CA-AS sottoposti a TAVI rispetto alla sola terapia medica, altri 3 studi valutavano complicanze e outcome clinici della procedura in pazienti con CA-AS rispetto a pazienti con stenosi aortica isolata mentre un ultimo studio è stato incluso in entrambe le analisi. (3-8) Figura 1
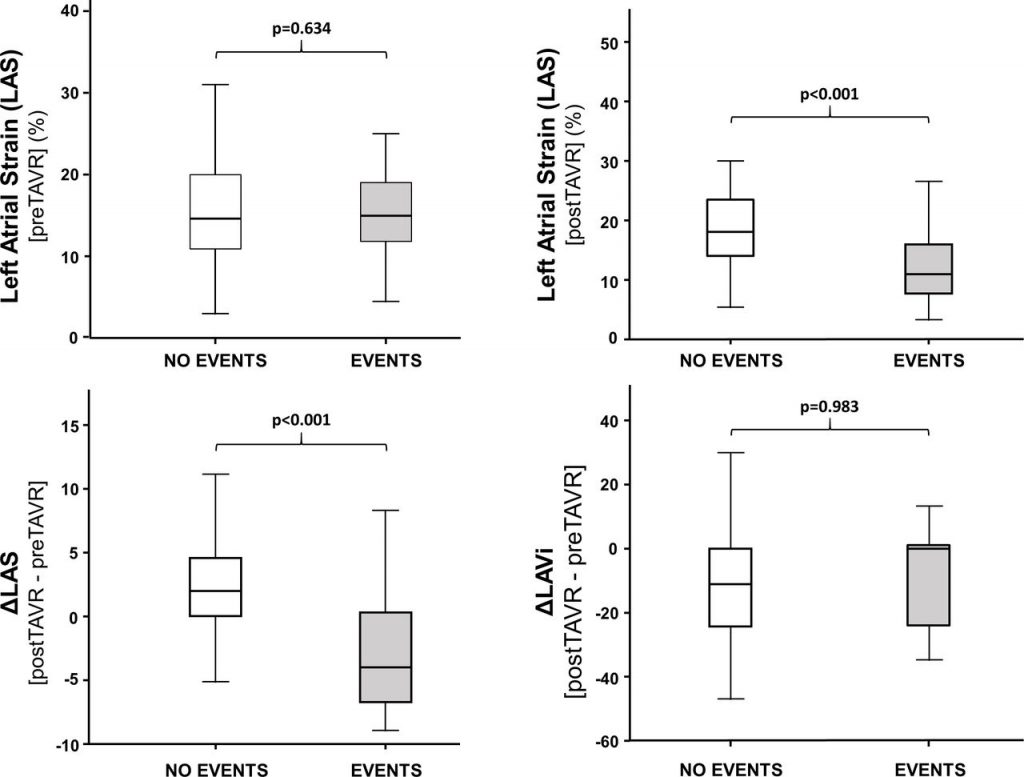
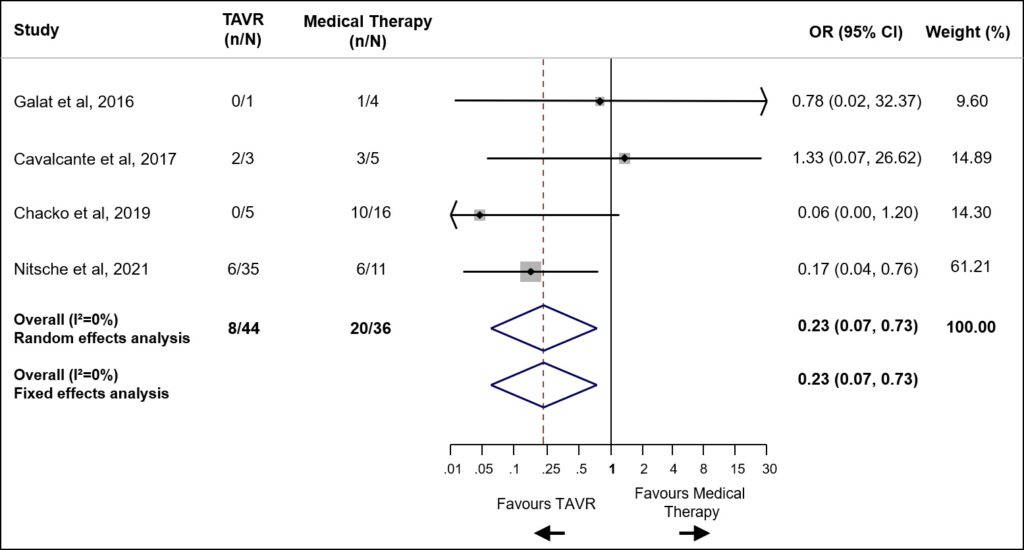
È stato quindi dimostrato un ridotto rischio di mortalità (18.2% vs 55.6%, OR 0.23, 95%CI 0.07-0.73, P=0.001, NNT=3) nella sottopopolazione di pazienti con CA-AS trattati tramite procedura di TAVI (n=44) rispetto alla sola terapia medica (n=36).Figura 2
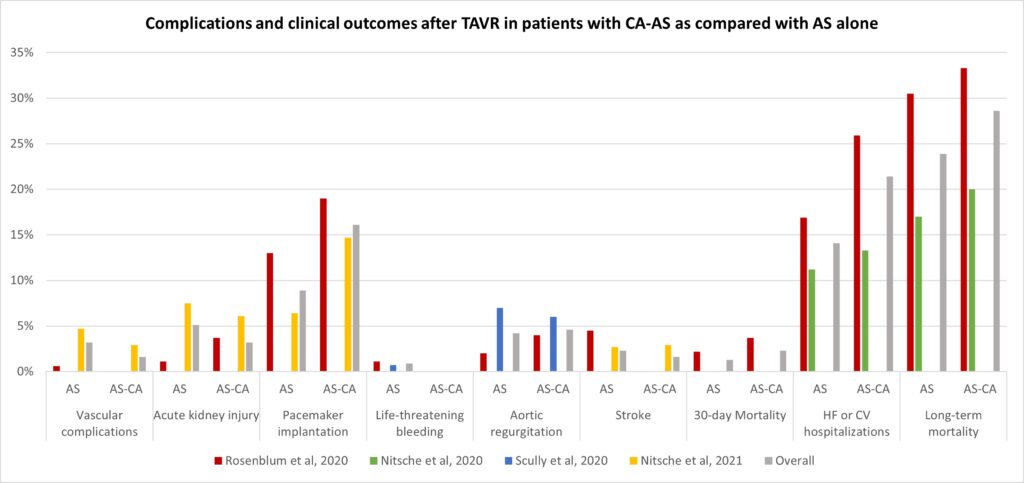
Nella seconda analisi, i pazienti con CA-AS (n=75) presentavano una mortalità comparabile (28.6% vs 23.9%, OR 1.11, 95% CI 0.67 – 1.85, p=0.687) ai pazienti con stenosi aortica isolata sottoposta a TAVI (n=536), così come un simile rischio di ospedalizzazione per cause cardiovascolari o scompenso cardiaco (21.4% vs 14.1%, OR 1.45, 95% CI 0.77 – 2.73, p=0.251); si notava solamente una tendenza ad un aumentato numero di impianti di pacemaker permanenti (16.1% vs 8.9%, OR 1.76, 95% CI 0.91 – 4.09, p=0.085).Figura 3
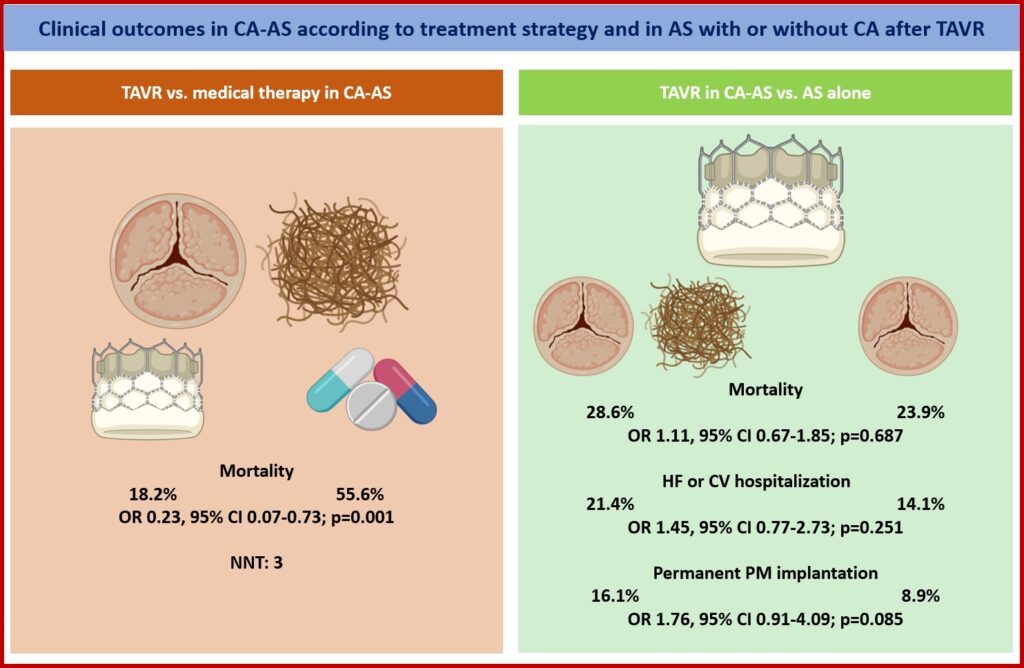
Pertanto, come riassunto nella Central Illustration, i principali risultati dello studio nel gruppo di pazienti con stenosi aortica severa sintomatica e cardiopatia amiloide trattati con procedura TAVI sono i seguenti:
- Una miglior sopravvivenza rispetto ai pazienti con CA-AS trattati con sola terapia medica, possibilmente legata alla riduzione del post-carico e delle pressioni di riempimento ventricolare sinistro conseguente alla risoluzione dell’ostruzione a livello della valvola aortica.
- Un rischio di complicanze periprocedurali paragonabile a quello dei pazienti con stenosi aortica severa isolata trattati con TAVI, fatta eccezione per una tendenza ad un aumentato rischio di impianto di pacemaker, che potrebbe essere spiegata dalla maggior degenerazione amiloide-relata del sistema di conduzione.
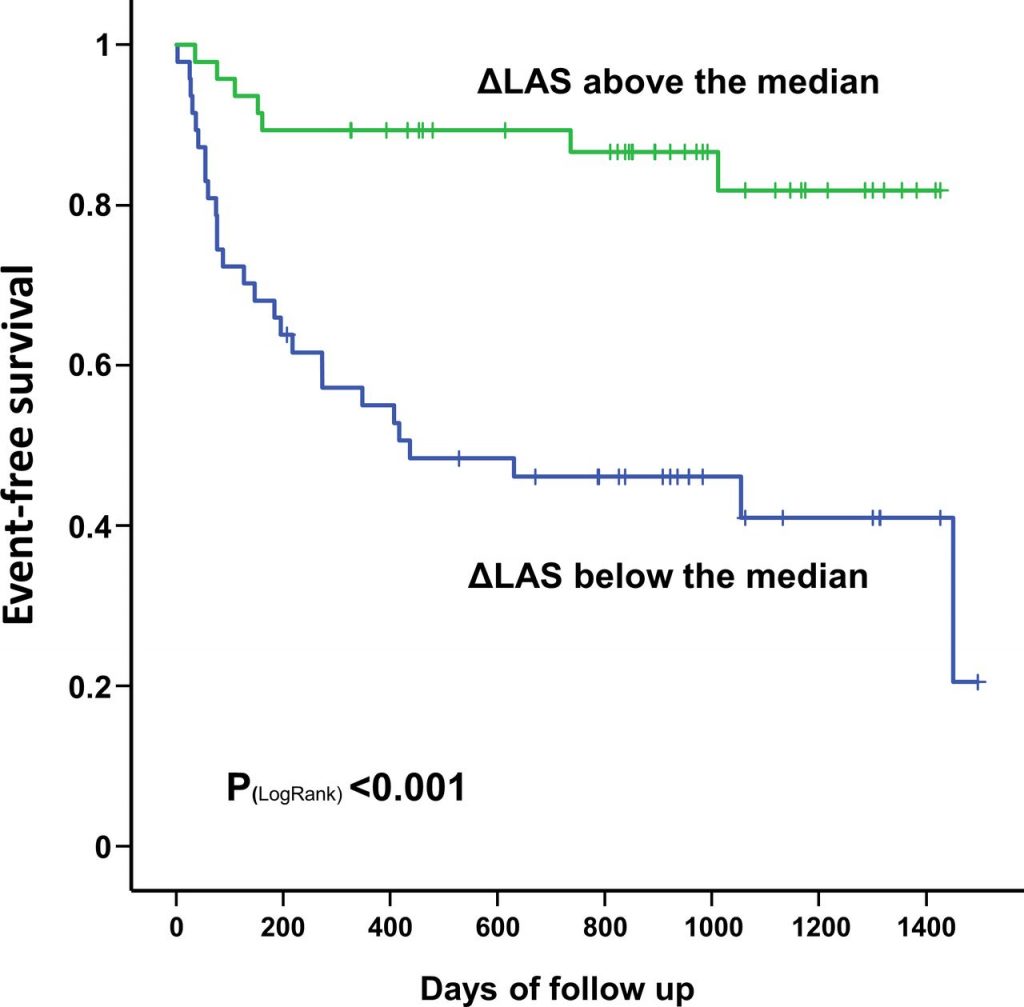
- Un rischio solo numericamente più elevato di riospedalizzazioni per cause cardiovascolari e mortalità a lungo termine, rispetto ai pazienti con stenosi aortica severa isolata trattati con TAVI.
In conclusione, pur con i limiti intrinseci ad una metanalisi study level di studi osservazionali, lo studio corrobora l’idea che la procedura di TAVI non debba essere considerata futile nella popolazione di pazienti con CA-AS, sebbene studi prospettici e randomizzati siano necessari per chiarire in maniera certa l’impatto della procedura sulla prognosi di questo sottogruppo di pazienti.
- Cannata F, Chiarito M, Pinto G et al. Transcatheter aortic valve replacement in aortic stenosis and cardiac amyloidosis: a systematic review and meta-analysis. ESC Heart Fail 2022 Jun 29. doi: 10.1002/ehf2.13876.
- Castaño A, Narotsky DL, Hamid N et al. Unveiling transthyretin cardiac amyloidosis and its predictors among elderly patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. Eur Heart J 2017;38:2879–2887.
- Nitsche C, Scully PR, Patel KP, Prevalence and outcomes of concomitant aortic stenosis and cardiaca myloidosis. JACC 2021;77:128–139.7.
- Cavalcante JL, Rijal S, Abdelkarim I et al Cardiac amyloidosis is prevalent in older patients with aortic stenosis and carries worse prognosis. J Cardiovasc Magn Reson 2017;19: 98
- Scully PR, Patel KP, Treibel TA, et al. Prevalence and outcome of dual aortic stenosis and cardiac amyloid pathology in patients referred for trans-catheter aortic valve implantation. Eur Heart J 2020;41: 2759–2767
- Galat A, Guellich A, Bodez D et al Aortic stenosis and transthyretin cardiacamyloidosis: the chicken or the egg? Eur Heart J 2016;37: 3525–3531.13.
- Chacko L, Martone R, Bandera F et al. Echocardiographic phenotype and prognosis in transthyretin cardiac amyloidosis. Eur Heart J 2020;0:1–10.14.
- Rosenblum H, Masri A, Narotsky DL, et al. Unveiling outcomes in coexisting severe aortic stenosis and transthyretin cardiac amyloidosis. Eur J Heart Fail2021;23: 250–258.15.
- Nitsche C, Aschauer S, KammerlanderAA et al. Light-chain and transthyretin cardiac amyloidosis in severe aortic stenosis: prevalence, screening possibilities, and outcome. Eur J Heart Fail 2020;22:1852–1862