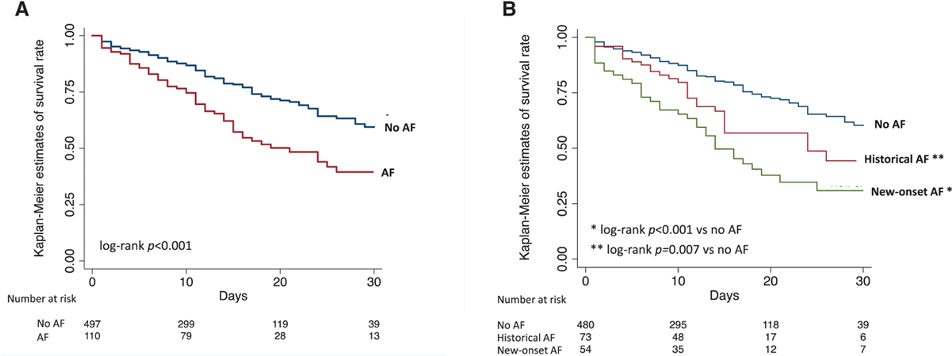
Autori: Claudio Laudani1 , Antonio Greco1 , Giovanni Occhipinti1 , Salvatore Ingala1 , Dario Calderone1 , Lorenzo Scalia1 , Federica Agnello1 , Marco Legnazzi1 , Maria Sara Mauro1 , Carla Rochira1 , Sergio Buccheri2 , Roxana Mehran3 , Stefan James2 , Dominick J Angiolillo4 , Davide Capodanno1
Affiliazioni:
1 Divisione di Cardiologia, Azienda Ospedaliero Universitaria Policlinico “G. Rodolico-San Marco”, Università degli Studi di Catania, Catania, Italia.
2 Department of Medical Sciences, Cardiology and Uppsala Clinical Research Center, Uppsala University, Uppsala, Sweden.
3 The Zena and Michael A. Wiener Cardiovascular Institute, Icahn School of Medicine at Mount Sinai, New York, New York, USA.
4 Division of Cardiology, University of Florida College of Medicine, Jacksonville, Florida, USA.
Commento di Marco Legnazzi, Divisione di Cardiologia, Azienda Ospedaliero Universitaria Policlinico “G. Rodolico-San Marco”; Università degli Studi di Catania – Catania
ABSTRACT
Nei pazienti con sindrome coronarica acuta sottoposti a PCI, le strategie per diminuire il rischio emorragico includono un accorciamento della DAPT (short DAPT) e il “depotenziamento” (de-escalation) della DAPT (uso di inibitore del recettore P2Y12 meno potente). Tuttavia, tali strategie non sono state mai confrontate direttamente in studi randomizzati. Abbiamo dunque realizzato una network meta-analysis di 50602 pazienti da 29 studi, che ha comparato indirettamente la short DAPT con la de-escalation, usando la DAPT standard come comune comparatore. Non abbiamo osservato una differenza significativa in termini di mortalità da tutte le cause; la de-escalation ha però ridotto il rischio di NACE, mentre la short DAPT è risultata il miglior trattamento per ridurre il rischio di sanguinamento maggiore.
COMMENTO
In pazienti con sindrome coronarica acuta (SCA) trattati mediante angioplastica percutanea, la DAPT (dual antiplatelet therapy – duplice terapia antiaggregante) è raccomandata per 12 mesi in assenza di controindicazioni come l’alto rischio di sanguinamento. Il rischio emorragico, infatti, è il principale effetto avverso della DAPT ed è associato a morbilità e mortalità significative.
Attualmente, esistono due strategie di modulazione della DAPT per ridurre il rischio emorragico: l’accorciamento della DAPT (short DAPT) e la de-escalation (il passaggio ad un inibitore del recettore P2Y12 meno potente o con dosaggio ridotto). Nelle linee guida dell’European Society of Cardiology sulle SCA senza sopraslivellamento del tratto ST, pubblicate nel 2020, per i pazienti ad alto rischio di sanguinamento (stimato tramite score quali il PRECISE-DAPT o l’ARC-HBR), la strategia di short DAPT (3 mesi di DAPT seguita da monoterapia antiaggregante) è indicata come raccomandazione di classe IIa, mentre la de-escalation della DAPT è indicata come raccomandazione di grado IIb.
In assenza di un confronto diretto tra le strategie di short DAPT e DAPT de-escalation, abbiamo realizzato una network meta-analysis con metodologia frequentista e Bayesiana che ha comparato le due strategie, in maniera indiretta, attraverso l’analisi di 29 studi randomizzati o sottoanalisi di studi randomizzati, per un totale di 50602 pazienti.
Le fonti dei dati includevano studi riportati sui database MEDLINE, Cochrane e Web of Science, dal 1° Gennaio 2009 al 30 Ottobre 2021. Sono stati consultati anche siti web delle società e associazioni di riferimento, e la lista bibliografica di ogni studio eleggibile. Il rischio di bias è stato valutato per ogni studio della selezione finale attraverso la scala Cochrane RoB 2. Il bias di pubblicazione è stato valutato con il test di regressione di Egger e la verifica visuale dei funnel plot.
La network meta-analysis ha raccolto i risultati di diversi trial randomizzati su pazienti sottoposti a PCI per SCA:
- Trials di short DAPT vs standard DAPT
- Trials di de-escalation vs standard DAPT
Essendo soddisfatto il presupposto della transitività (simili caratteristiche demografiche e cliniche tra gli studi di short DAPT e di de-escalation), e poiché gli studi di short DAPT e di de-escalation presentavano un comparatore comune (standard DAPT), è stato possibile confrontare indirettamente le due strategie. La short DAPT è stata definita come interruzione a 1-6 mesi di uno dei due antiaggreganti; la de-escalation invece è stata definita come 12 mesi di DAPT con shift, ad un certo punto, da prasugrel o ticagrelor a clopidogrel o a dose dimezzata di prasugrel o ticagrelor; la standard DAPT, utilizzata come termine di paragone, è stata definita come DAPT per la durata standard di 12 mesi.
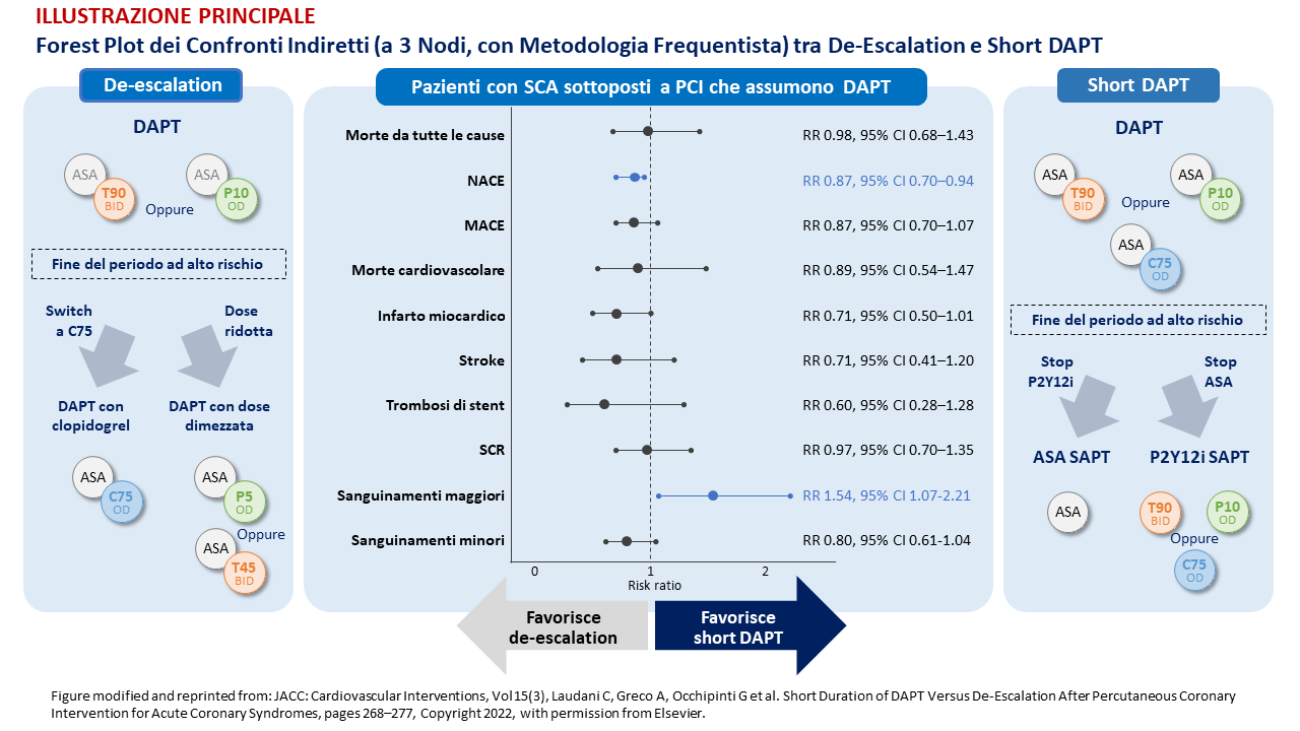
In considerazione dei risultati, le due strategie sono apparse equivalenti per molti aspetti, non essendoci differenze significative in termini di mortalità da tutte le cause, mortalità cardiovascolare, eventi cardiovascolari avversi maggiori, infarto miocardico, stroke, trombosi di stent. Sono tuttavia emersi dei meriti specifici, come il minor tasso di emorragie maggiori con la short DAPT e la minor incidenza di NACE (net adverse cardiovascular events) con la de-escalation. I risultati delle analisi frequentiste sono stati confermati dalle analisi Bayesiane e dalle multiple analisi di sottogruppo e di sensibilità eseguite.
Considerando la gerarchia delle evidenze scientifiche, un confronto indiretto è sicuramente subottimale rispetto ad un confronto diretto su larga scala, ma al momento questa meta-analisi rappresenta l’unico studio basato su dati randomizzati che mette a paragone le due strategie di modulazione della DAPT. Inoltre, l’utilizzo di modalità di analisi differenti (frequentistica e Bayesiana) e la loro concordanza corroborano l’affidabilità dei risultati riportati.
Dal punto di vista pratico, questi dati possono guidare la personalizzazione della DAPT in base agli obiettivi del trattamento e al profilo di rischio del singolo paziente. In caso di fondato motivo di preoccupazione relativo al sanguinamento, la short DAPT potrebbe essere preferibile alla de-escalation, che al contrario potrebbe rappresentare la strategia di scelta se la preoccupazione riguarda soprattutto la combinazione del rischio trombotico e ischemico.
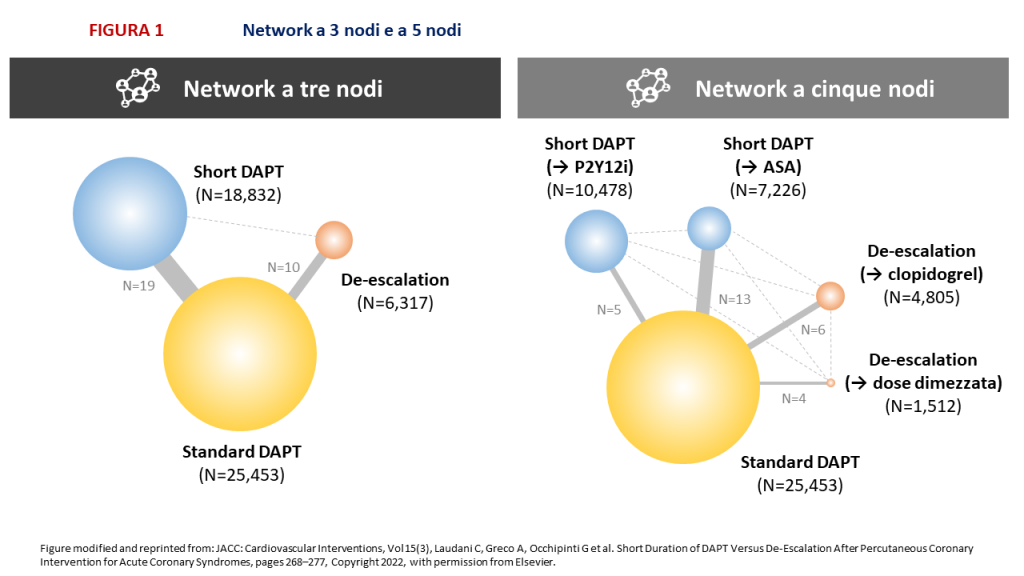
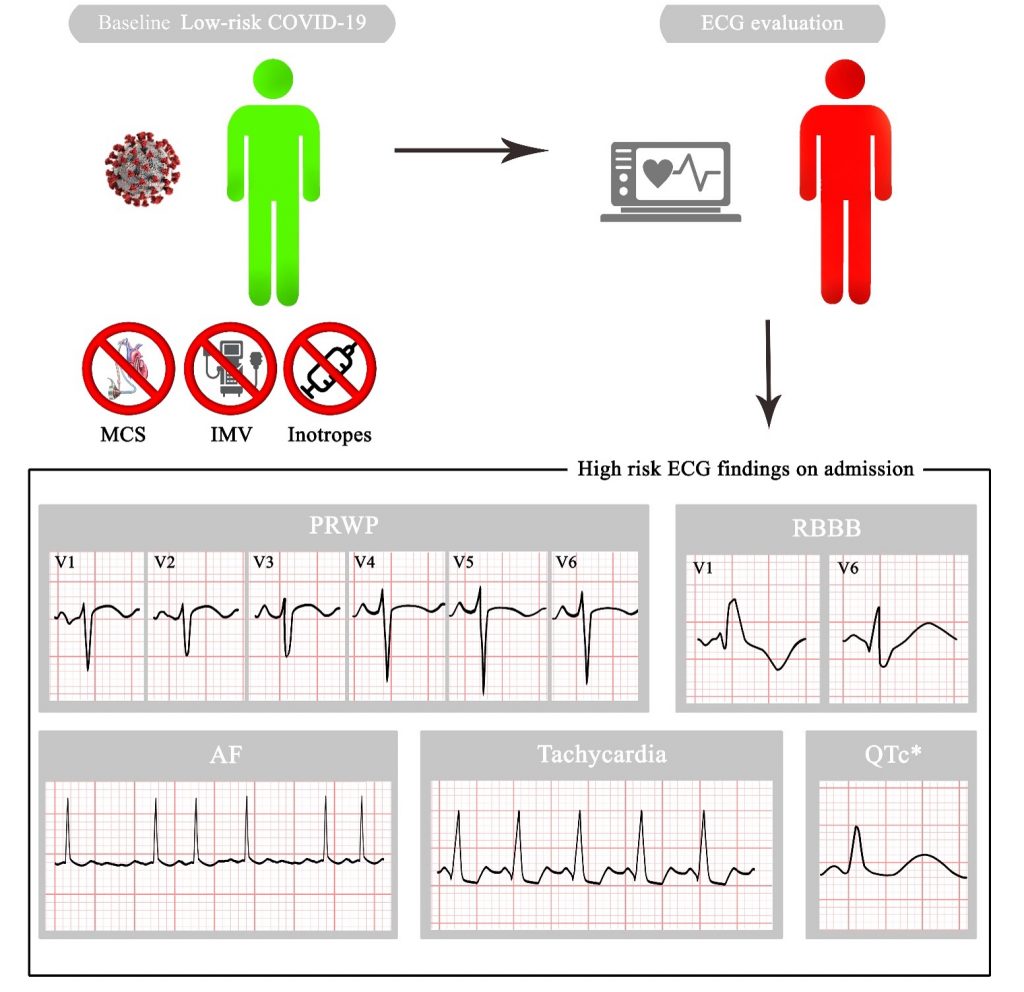
FIGURA 1: Ogni strategia è rappresentata da un nodo, di dimensioni proporzionali al numero totale di soggetti che hanno ricevuto quel trattamento. I confronti tra strategie sono rappresentati da linee tra i nodi, con spessore delle linee proporzionale al numero di studi disponibile per quella specifica comparazione. Le linee solide raffigurano confronti diretti. Le linee tratteggiate raffigurano confronti indiretti. ASA = acido acetilsalicilico; DAPT= dual antiplatelet therapy – duplice terapia antiaggregante; P2Y12i = inibitore del recettore P2Y12.
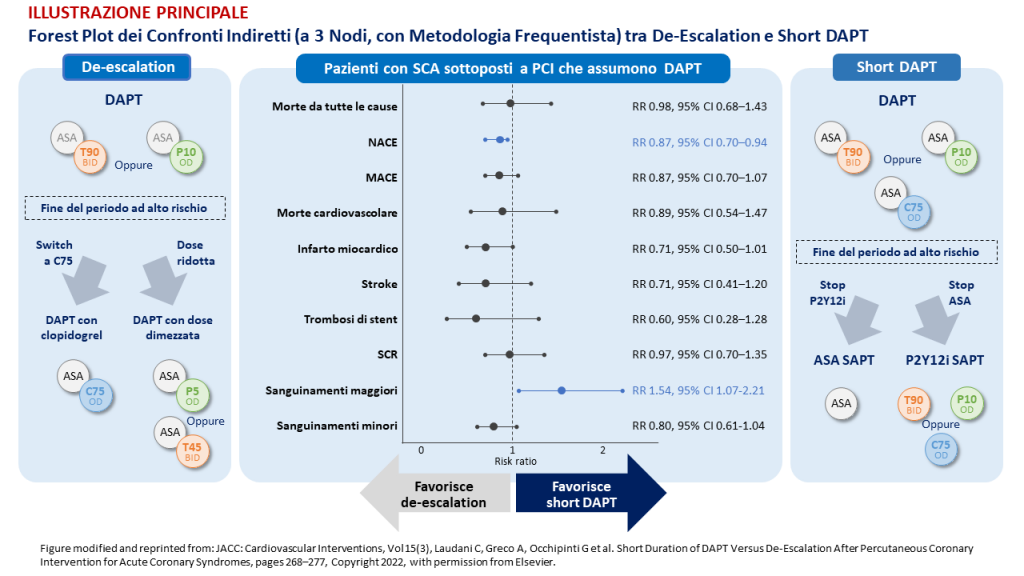
ILLUSTRAZIONE PRINCIPALE: ASA = acido acetilsalicilico; BID = bis in die; C75 = clopidogrel 75 mg; DAPT = dual antiplatelet therapy – duplice terapia antiaggregante; NACE = net adverse cardiovascular events; OD = once daily – una somministrazione al giorno; P2Y12i = inibitore del recettore P2Y12; P5 = prasugrel 5 mg; P10 = prasugrel 10 mg; SAPT = single-antiplatelet therapy – monoterapia antiaggregante; SCA = sindrome coronarica acuta; SCR = sanguinamento clinicamente rilevante; T45 = ticagrelor 45 mg; T90 = ticagrelor 90 mg.]
BIBLIOGRAFIA:
- Laudani C, Greco A, Occhipinti G, Ingala S, Calderone D, Scalia L, Agnello F, Legnazzi M, Mauro MS, Rochira C, Buccheri S, Mehran R, James S, Angiolillo DJ, Capodanno D. Short Duration of DAPT Versus De-Escalation After Percutaneous Coronary Intervention for Acute Coronary Syndromes. JACC Cardiovasc Interv. 2022 Feb 14;15(3):268-277. doi: 10.1016/j.jcin.2021.11.028.
- Kereiakes DJ, Yeh RW. DES and DAPT in Evolution: Will Clinical Guidelines Follow? JACC Cardiovasc Interv. 2022 Feb 14;15(3):278-281. doi: 10.1016/j.jcin.2021.12.014.
More on:
https://www.jacc.org/doi/full/10.1016/j.jcin.2021.11.028
https://pubmed.ncbi.nlm.nih.gov/35144783/
https://www.sciencedirect.com/journal/jacc-cardiovascular-interventions
Figures modified and reprinted from: JACC: Cardiovascular Interventions, Vol 15(3), Laudani C, Greco A, Occhipinti G et al. Short Duration of DAPT Versus De-Escalation After Percutaneous Coronary Intervention for Acute Coronary Syndromes, pages 268–277, Copyright 2022, with permission from Elsevier.